نظرية تشرد الكهرليتات لأرينيوس Arrhenius electrolyte dissociation theory
نظرية تشرد الكهرليتات لأرينيوس Arrhenius electrolyte dissociation theory
لقد جمع أرينيوس عام 1884 بين حقيقة ازدياد عدد الجسيمات عند انحلال الكهرليت Electrolyte وحقيقة وجود الشوارد في المحلول وتوصل إلى الفرضيات التالية:
1ـ أن جزيئات الحموض والأسس والأملاح (الكهرليتات) تتفكك عند انحلالها في الماء إلى نموذجين من الجسيمات المشحونة كهربائياً تحمل إحداهما شحنة موجبة بينما تحمل الأخرى شحنة سالبة. وأطلق على هذه الشحنات اسم شوارد.
-AB ↔ A+ + B
شوارد كهرليت
لقد استخدم أرينيوس الكلمات ذاتها التي أُختلقها عام 1834 العالم الانكليزي مايكل فارادي في بحثه حول ظاهرة التفكك الكيميائي الناتج بفعل التيار الكهربائي: " كهرليت Electrolyte، شاردة Ion، شاردة موجبة الشحنة Cation وأُخرى سالبة الشحنة Anion ، مسرى Electrode ، المسرى ذي الكمون الأعلى Anode والمسرى ذي الكمون الأخفض Cathode " . واشتقاقياً ( من علم اشتقاق الكلمات ) كلمة Electrolyte وُضعت استناداً على فكرة تبين فيما بعد أنها خاطئة.
2ـ يتألف الكهرليت الصلب من شوارد تبقى مرتبطة ببعضها البعض بقوى تجاذب كهربائية (Electrostatic) ، وعندما ينحل الكهرليت في الماء ، تضعف هذه القوى ويتفكك الكهرليت إلى شوارد. تكون الشوارد مميهة:
-A+B- ↔ A+ + B أو (A+B- + aq ↔ A+(aq) + B-(aq
3ـ وصف عملية تفكك جزيئات الكهرليت إلى شوارد بالتشرد Ionization .
4ـ عرف درجة التشرد أو درجة التفكك بأنه الجزء من العدد الكلي للجزيئات الموجودة في المحلول على شكل شوارد ورمز لها بـِ α :
5ـ لا تتشرد جميع الكهرليتات بنفس الكمية، فبعضها يتشرد كلياً تقريباً بينما يكون تشرد البعض الآخر ضعيفاً.
6ـ تتعلق درجة التشرد بعوامل متعددة: طبيعة الكهرليت، درجة التمديد ودرجة الحرارة.
7ـ تتحد باستمرار من جديد الشوارد في المحلول لتشكيل جزيئ معتدل، وهكذا يوجد حالة توازن ديناميكي بين الشوارد وبين الجزيئات غير المتشردة: -AB ↔ A+ + B
وأطلق اسم ثابت التشرد على ثابت التوازن K في قانون فعل الكتلة: ![]()
8ـ أطلق على الجزيئ الذي يملك قيمة K كبيرة بالكهرليت القوي والذي يملك قيمة ضعيفة بالكهرليت الضعيف.
9ـ فسّر عملية التحليل الكهربائي Electrolysis التي درسها فاراداي : عندما يمر تياراً كهربائياً في محلول كهرليتي تتحرك الشوارد الموجبة باتجاه الكاتود Cathode بينما تتحرك الشوارد السالبة باتجاه الآنود Anode وتفرغ شحنتها.
10ـ المحاليل معتدلة الكهربائية دائماً، بمعنى أن الشحنة الكلية لزمرة إحدى الشوارد تساوي إلى الشحنة الكلية للزمرة الثانية من الشوارد وليس ضرورياً أن يكون عدد الشوارد في الزمرتين متساوياً دوماً.
(الشحنتان متساويتان) -AB ↔ A+ + B
(الشوارد السالبة ضعف الموجبة) -AB2 ↔ A2+ + 2B
( الشوارد السالبة ضعف الموجبة) -A2B ↔ 2A+ + B2
11ـ إن خصائص الكهرليت في المحلول هي خصائص الشوارد الموجودة في المحلول.
فالمحلول الحمضي يحوي دائماً شوارد +H
بينما يحوي المحلول الأساسي على شوارد -OH
وخصائص المحاليل الحمضية تعود لخصائص شوارد +H بينما خصائص المحاليل الأساسية تعود شوارد -OH.
12ـ تتصرف الشوارد كما تتصرف الجزيئات على نحو أنها تخفض نقطة التجمد وترفع نقطة الغليان، تخفض ضغط البخار...ألخ.
13ـ تعتمد الناقلية الكهربائية للمحلول على طبيعة وعدد الشوارد وسرعتها.
ولشدة ما لقيته هذه الفرضيات من اعتراف واسع سرعان ما حظيت باسم نظرية التشرد.
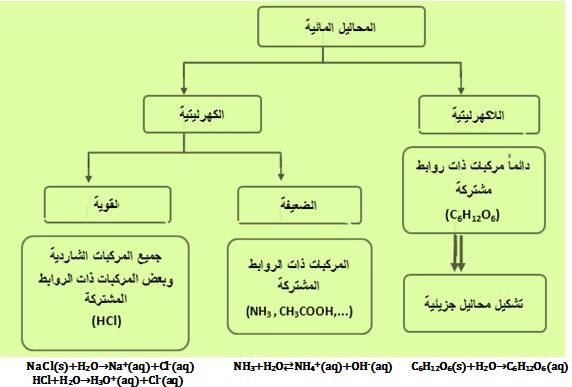
يُمكن تقسيم المواد بحسب تشردها في المحاليل إلى ثلاثة أنواع:
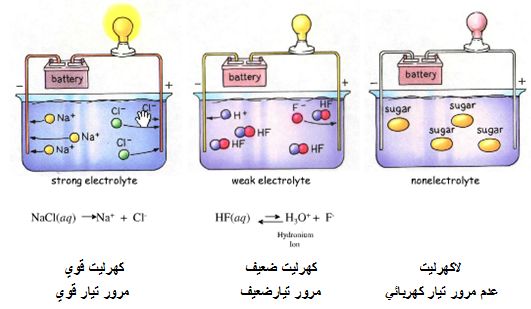
1ـ الكهرليتات القوية: تُدعى المواد التي تتشرد كلياً إلى شوارد (موجبة و سالبة) عندما تنحل في الماء بالكهرليتات القوية ومحاليلها المائية معتدلة كهربائياً وناقلة جيدة للتيار الكهربائي، ويُرمز لعملية التشرد هذه بالرمز → .
مثل: محلول مائي لحمض كلور الماء +HCl: HCl → Cl- + H
و محلول مائي لكلور الصوديوم -NaCl: NaCl→Na+ + Cl
إذ تبين من دراسة الخواص الطيفية لمحاليل الكهرليتات القوية عدم العثور على جزيئات غير متفككة من الكهرليت وأن ذلك لا علاقة له بتركيز الكهرليت.
ولذلك لا ينطبق قانون فعل الكتلة على الكهرليتات القوية.
إن الخواص الكيميائية للكهرليتات القوية تبدو وكأنها تتشكل من مجموع خواص الشوارد المناظرة في هذه المحاليل (بما أنه لا يوجد جزيئات غير متفككة فإنها لن تؤثر على خواص المحلول)، وهذا يؤدي إلى ظهور خواص جماعية تتصف بها كل الكهرليتات التي تحتوي على شاردة من نوع معين. فمثلاً تحتوي جميع أملاح الكلور وحمض كلور الماء على شاردة الكلور لذا فإنها تعطي جميعاً الراسب AgCl عندما تتفاعل مع AgNO3 ، وكذلك فإن الحمض لا يؤثر بشاردته السالبة ولا بالجزيء غير المتفكك وإنما يؤثر بشاردة الهيدروجين. وكلما ازداد تركيز شوارد الهيدروجين ازداد بوضوح جميع الخواص الحمضية للمحلول. وبصورة مماثلة يُمكن القول بأن جميع الخواص العائدة إلى الأسس تتحقق بفعل شوارد الهيدروكسيل -OH فكلما ازداد تركيز هذه الشوارد اشتدت جميع الخواص الأساسية (القلوية) للمحلول.
2ـ الكهرليتات الضعيفة: إن المواد التي تتشرد جزئياً إلى شوارد (موجبة وسالبة) أي أن قسماً من المادة المنحلة يتشرد فقط أما القسم الباقي فيبقى في المحلول محافظاً على شكله الأصلي غير المتشرد فتُدعى بالكهرليتات الضعيفة ومحاليلها المائية معتدلة كهربائياً وناقلة بشكل ضعيف للتيار الكهربائي، ويُرمز لعملية التشرد هذه بالرمز ↔ .
مثل: محلول مائي للنشادر (ماءات الأمونيوم) -NH4OH : NH4OH↔NH4++OH
و محلول مائي لحمض الخل +CH3COOH: CH3COOH ↔CH3COO-+H
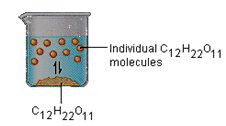
3ـ اللاكهرليتات: وهي تلك المواد التي تنحل في الماء ولكنها تحافظ على سلامتها الجزيئية (أي لا تتفكك إلى شوارد) وبالتالي محاليلها المائية غير قادرة على نقل التيار الكهربائي، مثل السكر والكحول.
إضافة تعليق
التعديل الأخير تم: 02/07/2021