الجداء الشاردي للماء water ions product
الجداء الشاردي للماء water ions product
يُعتبر الماء النقي ناقلاً رديئاً للتيار الكهربائي، ويُمكن تفسير مقدرة الماء على نقل التيار الكهربائي بافتراض التشرد الضعيف لجزيئاته :
التحليل الذاتي للماء -H2O+H2O ↔ H3O+ + OH
ولما كانت درجة تشرد الماء صغيرة، فإن التركيز الجزيئي الحجمي لكل منشوارد الهيدرونيوم [+H3O] وشوارد الهيدروكسيل [-OH] سيكون صغيراً أيضاً. من تطبيق قانون فعل الكتلة على توازن تشرد الماءفي درجة حرارة محددة :
أو: [-K.[H2O]2 = [H3O+].[OH
إن التركيز الجزيئي للماء يُعادل تقريباً : ![]() وقد وُجد من خلال قياس الناقلية الكهربائية للماء النقي أن تركيز كل من شوارد الهيدرونيوم و شوارد الهيدروكسيل يُساوي تقريباً 7-10 شاردة غرامية في الليتر في الدرجة25oC ، أي أن كل شاردة واحدة من الهيدرونيوم أو الهيدروكسيل تقابل 55.107mol ، وبعبارة أُخرى إنه من بين 550 مليون جزيئة ماء تتشرد جزيئة واحدة في الدرجة 25oC ، لذلك يُمكن اعتبار أنه في الماء النقي أو في المحاليل المائية الممدة يبقى تركيز الماء ثابتاً إلى حد كبير بحيث يُمكن كتابة العلاقة التالية:
وقد وُجد من خلال قياس الناقلية الكهربائية للماء النقي أن تركيز كل من شوارد الهيدرونيوم و شوارد الهيدروكسيل يُساوي تقريباً 7-10 شاردة غرامية في الليتر في الدرجة25oC ، أي أن كل شاردة واحدة من الهيدرونيوم أو الهيدروكسيل تقابل 55.107mol ، وبعبارة أُخرى إنه من بين 550 مليون جزيئة ماء تتشرد جزيئة واحدة في الدرجة 25oC ، لذلك يُمكن اعتبار أنه في الماء النقي أو في المحاليل المائية الممدة يبقى تركيز الماء ثابتاً إلى حد كبير بحيث يُمكن كتابة العلاقة التالية:
Ke = ثابت = [- K.[H2O]2 = [H3O+].[OH
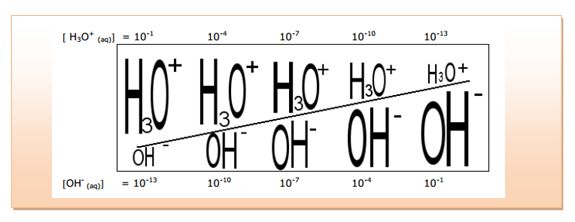
يُسمى هذا الثابت Ke بالجداء الشاردي للماء .إن قيمة هذا الثابت يُساوي 14-10 في الدرجة 25oC، لذلك يكون: H3O+]=[OH-]=10-7 mol/L] في الدرجة 25oC .
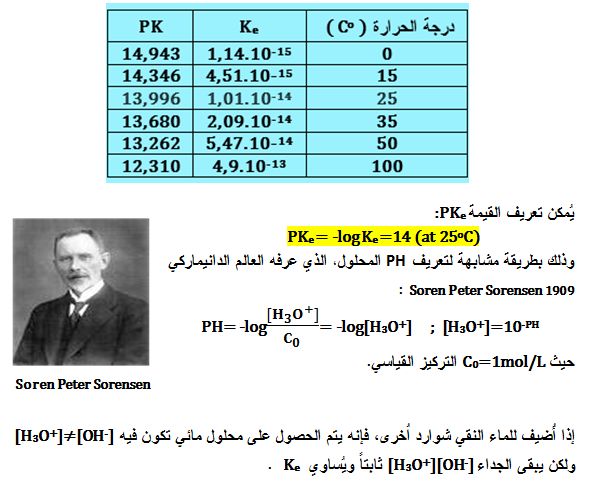
ولما كان تشرد الماء تفاعل ماص للحرارة ، لذلك ينزاح توازنه نحو اليمين بارتفاع درجة الحرارة حسب لوشاتولييه، أي أن درجة تشرد الماء تزداد عندئذ ، ينتج عن ذلك أن قيمة Ke تتعلق بدرجة الحرارة كما في الجدول التالي:
- Ke أو Kw في المصادر الإنكليزية والأمريكية (w≡water) ، (e≡eau) .
إضافة تعليق
التعديل الأخير تم: 02/07/2021