إماهة وانحلال الشوارد في الماء Hydration and ions dissolution in water
إماهة وانحلال الشوارد في الماء Hydration and ions dissolution in water
الإماهة هي نوع من أنواع الانحلال salvation والتي تعني حسب المفهوم العام إحاطة جزيئات المحل بالمادة المنحلة ، فعندما يكون المحل عبارة عن الماء تسمى العملية بالإماهة.
الإماهة يمكن أن يقصد بها:
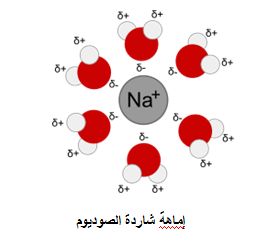
1ـ تجمع جزيئات الماء حول الشوارد المنحلة، حيث تنشأ ما يعرف بكرة مائية حول الشاردة المركزية.
2ـ تجمع جزيئات الماء حول الجزيئات المعتدلة القطبية ، خاصة عند إمكانية نشوء روابط هيدروجينية.
تنشأ الإماهة نتيجة قوى كهربائية ساكنة بين الشوارد المشحونة و ثنائي القطب الخاص بجزيئات الماء (الفعل المتبادل بين الشوارد وثنائي القطب). تحصل نتيجة هذا التقارب نشوء روابط هيدروجينية فتتشكل كرة ماء داخلية محيطة بالشاردة المركزية.
ولقد تأكدت إماهة الشوارد في المحاليل المائية بفضل أبحاث كابلوكوف وجونس عام 1891 فهي تبرز في جميع خواص هذه المحاليل. ومن نتائجها قدرة العديد من الكهرليتات على ربط كمية من الماء عند انفصالها من المحاليل جيث تكون على شكل ماء متبلور. وإماهة الشوارد بالذات هي التي تعرقل ضم الشوارد وتحولها إلى جزيئات من جديد. ويكون التأثير المتبادل الشاردي ثنائي القطب أشد ما يمكن عند إماهة الشوارد الموجبة التي تتمتع بنصف قطر صغير (مثل +Li )
وخاصة الشوارد التي تتمتع في آن واحد بنصف قطر صغير وبشحنة كبيرة ( مثل +Al3 ).
تظهر علاقة درجة إماهة الشوارد بأبعادها واضحة لدى مقارنة الناقلية الكهربائية عند مختلف الكهرليتات. إذ من الممكن التوقع بأنه طالما أن أنصاف الأقطار للشوارد الموجبة تزداد في الحالة البلورية من+Li إلى+Cs فإن أشدها توصيلاً للتيار الكهربائي هو كلور الليتيوم واضعفها هو كلور السيزيوم. بيد أن الأمر على عكس ذلك في المحاليل المائية فالشاردة +Li تتميه بدرجة أكبر نظراً لصغر حجمها وهذا يخفض كثيراً سرعة انتقالها في المحلول مما يجعل الناقلية الكهربائية لكلور الليتيوم أقل منها عند أملاح الكلور الأخرى.
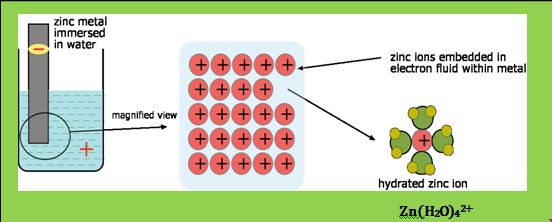
بشكل عام تُعاني جميع الشوارد في المحلول المائي من تفاعل الإماهة أي أنها تتواجد في المحاليل المائية بشكل شوارد مميهة ( محاطة بجزيئات الماء) +M(H2O)n]z] وهذا ما يزيد من استقرارها في المحلول.
إن قوة الارتباط بين الشاردة المعدنية وجزيئات الماء تزداد بازدياد الشحنة الكهربائية z للشاردة المعدنية وتتناقص بازدياد قطر الشاردة المعدنية.
أمثلة: +Cu(H2O)42+ , Ni(H2O)62+ , Cr(H2O)3+ , Zn(H2O)42 , و +(H(H2O
وللتبسيط ، تُكتب الشاردة المميهة على النحو التالي:
(Cu2+(aq), Ni2+(aq) , Cr3+(aq) , Zn2+(aq) و (H+(aq.
أو:
+Cu2+ , Ni2+ , Cr3+ , Zn2 و +H3O.
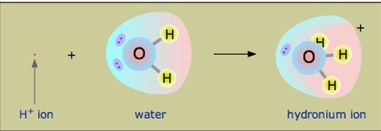
تُدعى شاردة الهيدروجين المميهة +(H(H2O أي +H3O بشاردة الهيدرونيوم.
إضافة تعليق
التعديل الأخير تم: 02/07/2021