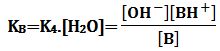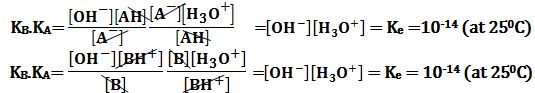قوة حمض أو أساس برونشتد-لوري Strength of acid or base, according to Bronsted-Lowry
قوة الحمض أو الأساس حسب برونشتد-لوري Strength of acid or base, according to Bronsted-Lowry
تزداد قوة الحمض بازدياد سهولة تحريره للبروتون، وتتناقص قوة الأساس المرافق بازدياد قوة الحمض.
يُمكن بسهولة إيجاد العلاقة بين ثابتي الحموضة والأساسية ( أو ثابت قوة الحمض وثابت قوة الأساس أو ثابت تشرد الحمض وثابت تشرد الأساس) لزوج (حمض ـ أساس مرافق) في الماء كما يلي:
ليكن الزوج -HA/A أو BH+/B:
يُعرف ثابت الحموضة KA للتفاعل +HA+H2O ↔A-+H3O ، حيث K1 ثابت توازن التفاعل المعتبر.
و يُعرف ثابت الحموضة KA للتفاعل +BH+ +H2O↔B+H3O ، حيث K2 ثابت توازن التفاعل المعتبر.
يُعرف ثابت الأساسية KB للتفاعل -A-+H2O ↔AH+OH ، حيث K3 ثابت توازن التفاعل المعتبر.
وكذلك يُعرف ثابت الأساسية KB للتفاعل -B+H2O ↔BH++OH ، حيث K4 ثابت توازن التفاعل المعتبر.
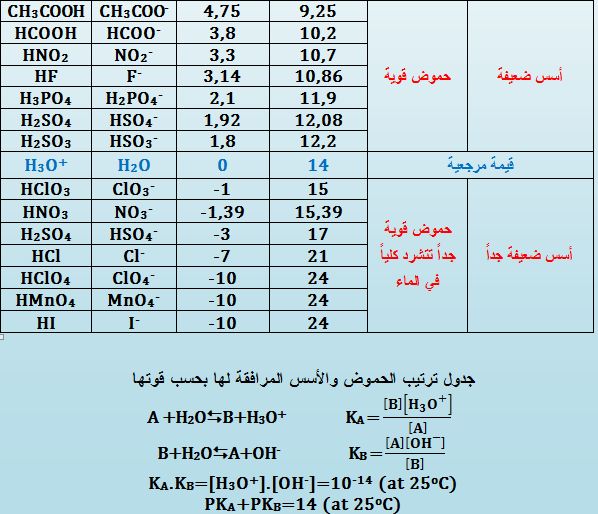
حساب قيمة الجداء KB.KA :
أي: at 250C) PKA+PKB =PK e= 14)
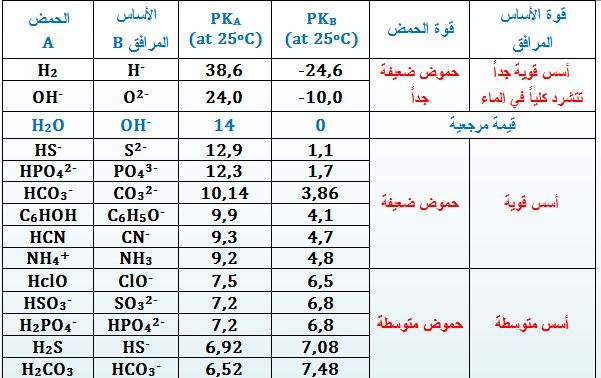
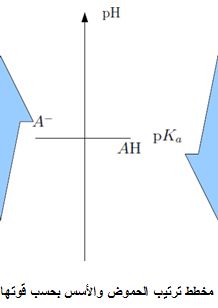
يُمكن مما سبق استنتاج أن الحمض يكون قوياً كلما كانت قيمة ثابته KA كبيرة أو PKA صغيرة ويُرافق هذا الحمض أساس ضعيف ( قيمة PKB كبيرة)، وبمنى آخر كلما ازدادت قيمة PKA كلما كان الحمض أضعف وكان الأساس المرافق له أقوى. وهكذا يُمكن ترتيب الحموض بحسب قوتها اعتماداً على قيم PKA بالنسبة لقيمة مرجعية PKA(H3O+/H2O )=0 .
تمرين ـ أوجد قيمة PKA لكل من زوجي الماء H3O+/H2O و -H2O/OH في الدرجة 25oC .
الزوج H3O+/H2O:
+H3O++H2O ↔ H2O +H3O
KA=[H3O+]/[H3O+]=1 → PKA=0
الزوج -H2O/OH :
+H2O+H2O↔OH-+ H3O
KA=[OH-].[H3O+]=Ke → PKA=14
إضافة تعليق
التعديل الأخير تم: 02/07/2021