الحمض والأساس بحسب لويس acid and base, according to Lewis
الحمض والأساس بحسب لويس acid and base, according to Lewis
هناك تفاعلات حمض ـ أساس لا يُمكن تفسيرها وفق نظرية برونشتد ـ لوري وإنما وفق نظرية وضعها لويس عام 1923، تنطبق على المحاليل المائية وغير المائية كما نظرية برونشتد ـ لوري ،
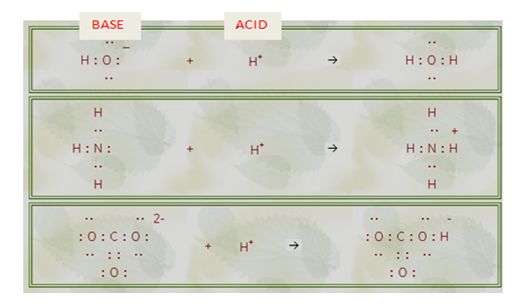
وبهذه النظرية يُعرف الأساس بأنه مادة (مانحة الكترونات) تحوي على أزواج الكترونية حرة تستطيع بها تشكيل روابط مع جزيئة أو ذرة أو شاردة، أما الحمض فهو مادة ( متقبلة الكترونات) تستطيع تشكيل روابط بقبولها لزوج الكتروني من الأساس .
أمثلة:
إن كل الشوارد الموجبة (cations) هي حموض لويس، كما أن قسماً كبيراً من المركبات التساندية (Coordination Compounds) يُمكن اعتبارها أسس لويس.
وهناك مثال شائع لحموض لويس لا يحتوي على الهيدروجين، إنه ثلاثي فلور البور BF3، الذي يقبل زوجاً الكترونياً من جزيء النشادر NH3 :
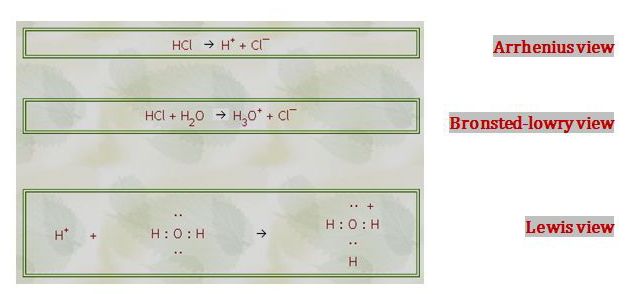
يُمكن النظر إلى تشرد محلول مائي لحمض كلور الماء من بحسب نظرية أرينيوس وبرونشتد-لوري ولويس كما يلي:
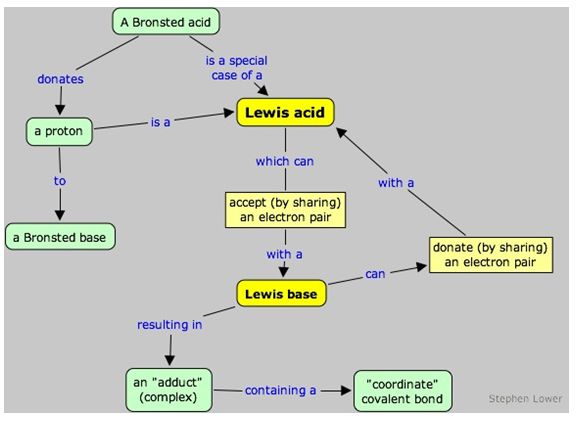
يُبين المخطط التالي تعريف الحمض والأساس بحسب بونشتد ـ لوري و لويس.
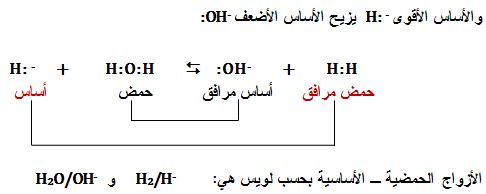
تمرين ـ تتفاعل شوارد الهيدريد -H مع الماء لتعطي ثنائي الهيدورجين وشوارد الهيدروكسيل.
1ـ اكتب صيغة لويس الموافقة لشاردة الهيدريد.
2ـ اكتب المعادلة المحصلة لتفاعل شاردة الهيدريد مع الماء، ثم بيّن أنه يمكن اعتباره تفاعل حمض مع أساس وحدد الأزواج حمض /أساس الداخلة فيه.
1ـ صيغة لويس الموافقة لشاردة الهيدريد -:H
2ـ تفاعل شاردة الهيدريد مع الماء:
-H- + H2O → H2 + OH
-H:- + H:O:H → H:H +:OH
إضافة تعليق
التعديل الأخير تم: 02/07/2021