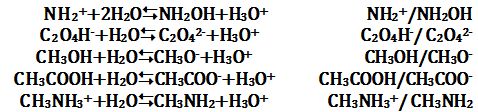الحمض والأساس حسب برونشتد-لوري acid and base, according to Bronsted-Lowry
الحمض والأساس بحسب برونشتد ولوري acid and base, according to Bronsted-Lowry
في عام 1922 نشر كل من برونشتد ولوري نظريته حول الحموض والأسس. وهي تنطبق على المحاليل المائية وغير المائية ، وبحسب هذه النظرية فإن:
Johannes-Bronsted
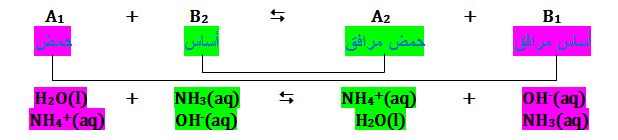
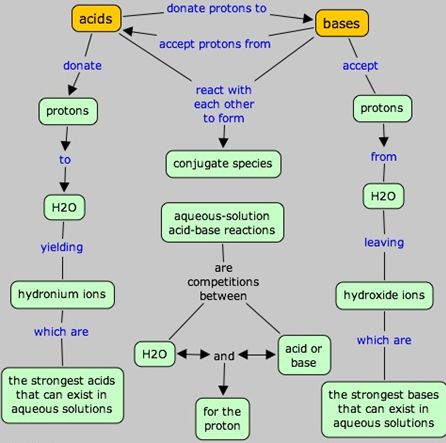
الحمض كل جزيء ، شاردة موجبة أو سالبة تكون قادرة على تحرير بروتون أو أكثر أو تجعل المحل يُحرر بروتون أو أكثر، ويُمكن التعبير عن ذلك بالمعادلة:
+A1 ↔ B1 + H
يُسمى A1 بحمض برونشتد كما يُسمى B1 بالأساس المرافق له.
والأساس كل جزيء أو شاردة تكون قادرة على أخذ بروتون أو أكثر، ويُمكن التعبير عن ذلك بالمعادلة:
B2 + H+ ↔ A2
يُسمى B2 بأساس برونشتد كما يُسمى A2 بالحمض المرافق له.
حسب هذه النظرية فإن تفاعل حمض مع أساس لا يؤدي إلى تشكيل ملح وماء وإنما لتشكيل حمض مرافق وأساس مرافق ناتجاً من انتقال بروتون من الحمض إلى الأساس. إن مفهوم تعديل حمض ـ أساس وفق هذه النظرية غير موجوداً . يُرفَق إذن كل حمض بأساس كما يُرفَق كل أساس بحمض، ويُعبر عن هذا الزوج بالشكل الكتابي حمض على أساس أي A1/B1 أو A2/B2 بحيث يُمكن كتابة المعادلة:
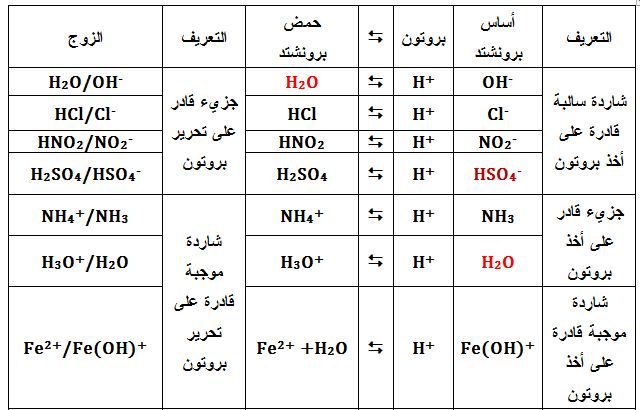
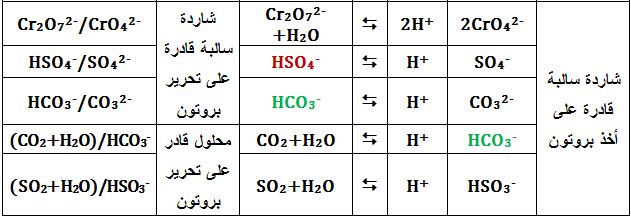
:عندما تلعب مادة ما ( جزيء أو شاردة ) دور حمض في زوج ودور أساس في زوج آخر تُسمى حينئذ بالمادة المتذبذبة . مثل
لكن وُجد محدودية نظرية برونشتد ـ لوري حيث أن عدداً من التفاعلات التي تتمتع بخصائص الحموض والأسس لا تترافق مع انتقال بروتونات +H مثل:
تمرين ـ علل الطبيعة الحمضية لكل من الشوارد والجزيئات الأتية:
Cr2O72-,Cu2+,SO3,H2O2,HCO3-,C6H5OH,NH4+,HCOOH,SO2, HClO4,H2,CH4,NH3
ثم اكتب صيغ الأزواج الحمضية/الأساسية الموافقة لكل منها مع المخطط الشكلي للتبادل البروتوني.
تمرين ـ علل الطبيعة الأساسية لكل من الشوارد والجزيئات الأتية:
NH2OH, C2O42-, CH3O-, CH3COO-, CH3NH2
ثم اكتب صيغ الأزواج الحمضية/الأساسية الموافقة لكل منها مع المخطط الشكلي للتبادل البروتوني.
تمرين ـ لماذا يُعتبر Zn(OH)2 كهرليتاً متذبذباً؟
لأنه يلعب تارة دور الحمض في الزوج -Zn(OH)2/ZnO22،
وتارة أُخرى يلعب دور الأساس في الزوج Zn2+/Zn(OH)2،
وذلك حسب ما يلي:
أ- الدور الحمضي له:
-Zn(OH)2+2H2O↔ZnO22-+2H3O+ Zn(OH)2/ZnO22
ويتم على مرحلتين:
(Zn(OH)2+H2O↔ZnO2H-+H3O+ Zn(OH)2/ZnO2H
-ZnO2H-+H2O↔ZnO22-+H3O+ ZnO2H-/ZnO22
ب- الدور الأساسي له
Zn2++4H2O↔Zn(OH)2+2H3O+ Zn2+/Zn(OH)2
ويتم على مرحلتين:
+(Zn2++2H2O↔Zn(OH)++H3O+ Zn2+/Zn(OH
Zn(OH)++2H2O↔Zn(OH)2+H3O+ Zn(OH)+/Zn(OH)2
تمرين ـ يتمتع كل من النشادر NH3 والإيتانول C2H5OH كالماء تماماً بتفاعل تحليل بروتوني ذاتي.
اكتب المعادلة المحصلة التي تعبر عن التحليل البروتوني الذاتي لكل الماء ، النشادر والإيتانول.
H2O + H2O ↔ H3O+ + OH- K=1.10-14
NH3 + NH3 ↔ NH2- + NH4+ K=3.10-33
C2H5OH + C2H5OH ↔ C2H5O- + C2H5OH2+ K=8.10-20
إضافة تعليق
التعديل الأخير تم: 02/07/2021