نظرية فيرنر في المعقدات Werner theory of complexes
نظرية فيرنر في المعقدات
تم تحضير عدد من المركبات التي لا تتشرد إلى عناصرها البسيطة عندما تنحل في الماء ،
بل تعطي تراكيب "معقدة" وذلك بخلاف الأملاح المزدوجة التي كانت معروفة حينها
كملح مور FeSO4.(NH4)2SO4.6H2O .
قام العالم السويسري الفريد فيرنر بعدة تجارب على ما تُسمى مركبات الكوبالت مع محلول النشادر المائي و شوارد الكلور.
أضاف فيرنر إلى محلول مائي لملح كلور الكوبالت الثلاثي (CoCl3) قطرات من نترات الفضة (AgNO3) فتكـون في الحال راسب ابيض من كلور الفضة (AgCl) يكافئ ثلاث ذرات كلور كما في المعادلة التالية :
CoCl3 + 3AgNO3 → 3AgCl + Co(NO3)3
وهذا يعني أن المحلول المائي من كلور الكوبالت الثلاثي يحتوي على شوارد الكلور -Cl (سالبة الشحنة) وشوارد الكوبالت الثلاثي +Co3 ( موجبة الشحنة) حيث تمكن فيرنر من التأكد من وجودها.
ثم أجرى فيرنر عدة تفاعلات بين محلول كلور الكوبالت الثلاثي ومحلول النشادر المائي، حيث تمكن الحصول على المركبات التالية :
|
|
صيغة المركب |
اللون |
|
1 |
CoCl3.6NH3 |
برتقالي |
|
2 |
CoCl3.5NH3 |
ارجواني |
|
3 |
CoCl3.4NH3 |
اخضر |
|
4 |
CoCl3.4NH3 |
بنفسجي |
|
5 |
CoCl3.3NH3 |
أزرق مخضر |
إن الفرق بين هذه المركبات من النظرة الأولى هو النسبة التي بين جزئ كلور الكوبالت الثلاثي إلى عدد جزيئات النشادر وهي
1/3,1/4,1/4,1/5,1/6 على التوالي .
لاحظ فيرنر أن جميع هذه المركبات أخفقت في ترسيب ماءات الكوبالت البني Co(OH)3 عند إضافة كل منها إلى محلول ماءات الصوديوم NaOH، واستدل فيرنر أن كل من هذه المركبات لا تحتوي على شاردة الكوبالت الثلاثي +Co3 . كما لاحظ أن هذه المركبات أخفقت في تشكيل كلور الأمونيوم NH4Cl عند معالجة كل منها في محلول حمض كلور الماء المركز HCl، واستدل فيرنر أن كل من هذه المركبات لا تحتوي على النشادر NH3.
تابع فيرنر وأجرى على محاليل هذه المركبات عدة اختبارات:
الاختبار الأول : إضافة شاردة الفضة (+Ag ) إلى محاليل هذه المركبات :
CoCl3.6NH3 + AgNO3 → 3 AgCl
CoCl3.5NH3 + AgNO3 → 2 AgCl
CoCl3.4NH3 + AgNO3 → AgCl
CoCl3.4NH3 + AgNO3 → AgCl
لا يتكون راسب → CoCl3.3NH3 + AgNO3
الاختبار الثاني : التحليل الكهربي :
|
|
المركب |
عند المصعد |
عند المهبط |
|
1 |
CoCl3.6NH3 |
-3Cl |
Co.NH3 |
|
2 |
CoCl3.5NH3 |
-2Cl |
-Co.NH3.Cl |
|
3 |
CoCl3.4NH3 |
-Cl |
-Co.NH3.Cl |
|
4 |
CoCl3.4NH3 |
-Cl |
-Co.NH3.Cl |
|
5 |
CoCl3.3NH3 |
لا يحدث تحليل كهربي |
- |
الاختبار الثالث : قياس الناقلية الكهربائية للمحاليل المائية لهذه المركبات لتعيين عدد الشوارد:
|
|
المركب |
عدد الشوارد |
|
1 |
CoCl3.6NH3 |
4 |
|
2 |
CoCl3.5NH3 |
3 |
|
3 |
CoCl3.4NH3 |
2 |
|
4 |
CoCl3.4NH3 |
2 |
|
5 |
CoCl3.3NH3 |
- |
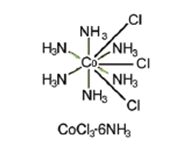
في حالة المركب الأول CoCl3.6NH3, استدل فيرنر من الاختبارين الأول والثالث على وجود أربعة شوارد ، ثلاثة منها هي شوارد كلور التي ترسبت على شكل كلور الفضة . بينما يدل الاختبار الثاني على أن شوارد الكلور الثلاثة تتجه إلى المصعد , والكوبالت يتجه إلى المهبط . ولكن ماذا عن جزيئات النشادر ؟ جزئ النشادر جزيء متعادل , ومن ثم لا يتأثر بمرور التيار الكهربي , بناء على ذلك , وحتى تصل جزيئات النشادر الستة إلى المهبط , لابد أن تكون مرتبطة بشحنة موجبة حتى يذهب بها إلى المهبط . وطالما لا يوجد شحنة موجبة غير الكوبالت يمكن التصور أن الكوبالت يرتبط بالجزيئات الستة بصورة ما , مكونة وحدة (Unit) بحيث أن الشحنة الموجبة لا تكون على الكوبالت وحده , وإنما على تلك الوحدة كلها , هذه الوحدة هي التي تتحرك في المحلول وتتجه إلى المهبط , وهي التي يطلق عليها اليوم اسم الشحنة المتراكبة أو المعقدة. تمكّن فيرنر من تفسير ذلك باعتبار أن الصيغة الجزيئية للمركب الأول هي
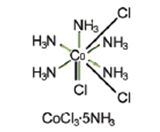
أما بالنسبة للمركب الثاني CoCl3.5NH3 ، فإن الاختبار الأول يدل على وجود شاردتين فقط من شوارد الكلور , أما الاختبار الثالث فيدل على وجود ثلاثة شوارد , إذن ما هي الشاردة الثالثة ؟ وأين شاردة الكلور الثالثة ؟ ولماذا اتجهت إلى المهبط مع أن المفروض انه يحمل شحنة سالبة ؟
يدل الاختبار الثالث على أن شاردتين فقط من شوارد الكلور الثلاثة , هي الموجودة في حالة مرتبطة بروابط الكتروستاتيكية , بينما شاردة الكلور (السالبة) وجزيئات النشادر (المتعادلة) والكوبالت قد اتجهت جميعا إلى المهبط (السالب) . تمكّن فيرنر من تفسير ذلك باعتبار أن الصيغة الجزيئية للمركب الثاني هي:
في هذه الحالة تكون الشوارد الثلاثة كما يدل الاختبار الثالث اثنان منها هما شوارد الكلور والثالث هو:
هذه الشاردة الأخيرة تحتوي على شاردة الكلور السالب , وشاردة الكوبالت الثلاثي الموجب وجزيئات النشادر الخمس .
بنفس الحجج السابقة تمكّن فيرنر من كتابة الصيغ الجزيئية للمركبات الأخرى كما يلي :
يلاحظ أن المركبان الثالث والرابع يحمل كل منهما شحنة موجبة واحدة , بينما المركب الخامس لا يحمل شحنة، والسبب في ذلك أن شحنات الكلور الثلاثة التي ارتبطت بالكوبالت عادلت شحنة الأخير (+3) ومن ثم أصبحت محصلة الشحنات تساوي صفرا بالنسبة لهذا المركب .
في كل حالة من الحالات السابقة تم تحضير مركب يختلف تماماً عن الجزيئات التي ساهمت في تكوينه , والاختلافات تشمل اللون والشحنة وعدد الشوارد الداخلة في تكوينه والناقلية ...الخ ، أو في عبارة مختصرة تختلف فيما بينها في الخواص الفيزيائية والكيميائية , ونظراً لأن هذه المركبات تشتمل على شوارد وجزيئات كل منها يمكن أن يوجد مستقلاً أو منفرداً (مثل ثالث كلور الكوبالت والنشادر في المركبات السابقة) , أي أنها مركبات ليست بسيطة فقد أطلق عليها اسم معقدات أو "متراكبات" (Complex) .
وضع فيرنر عام 1892 فرضية الروابط الإضافية لتأخذ بعين الاعتبار دخول الجزيئات المعتدلة في التفاعلات الكيميائية ، وذلك قبل وجود النظرية الإلكترونية للتكافؤ، ومنح فيرنر جائزة نوبل في الكيمياء عام 1913 عن جهوده في دراسة وتحضير وتفسـير عدد من المعقدات .
تنص نظرية فيرنر على أنه بالرغم من استنهاك قوة الارتباط في بعض الذرات، إلاَ أن هذه الذرات ما تزال في أغلب الأحيان تملك قوة للإشتراك في بناء جزيئات معقدة مشكلة في ذلك ارتباطات ذرية محددة جداً. إن امكانية تشكيل هذه الارتباطات تدل على أنه بجانب الروابط الرئيسية الموجودة في الذرة توجد روابط إضافية يُمكن للذرة الإستعانة بها. تُقسم قوى الاتحاد في الذرة وفق هذه النظرية إلى كرتي تجاذب وهما الكرة الداخلية والكرة الخارجية. فالجزيئات المعتدلة أو الشوارد المتعاكسة الشحنة تتساند مع بعضها حول شاردة مركزية وذلك في الكرة الداخلية ويدعى عندئذ عدد المجموعات الممكن ترتيبها حول الشاردة المركزية بعدد التناسق للشاردة المدروسة، لقد وجد فيرنر أيضاً أن الجزيئات والشوارد تترتب حول الشاردة المركزية بشكل تعطي معه تجمع فراغي متناظر.
تعتمد نظرية فيرنرعلى الفرضيات التالية :
1ـ لمعظم العناصر نوعان من التكافؤ :
ـ تكافؤ رئيسي يقابل درجة تكافؤ العنصر، الذي يُعرف بحسب فرانكلاند (1852) بأنه عدد ذرات الهيدروجين التي تتحد مع ذرة واحدة من هذا العنصر. 
ـ تكافؤ ثانوي يقابل عدد المجموعات الإضافية ( شوارد و/أو جزيئات) المرتبطة مباشرة مع العنصر.
2ـ يميل كل عنصر إلى إشباع كل من التكافؤ الرئيسي والثانوي .
3ـ التكافؤ الثانوي يأخذ اتجاهات محددة في الفراغ ، وهذه الفرضية هي الأساس في الكيمياء الفراغية للمعقدات.
وبحسب هذه النظرية فإن التكافؤ الرئيسي للكوبالت في المعقد CoCl3.6NH3 هو (+3) ، وبالتالي فأن شوارد الكلور الثلاثة تشبع هذا التكافؤ. هذه الشوارد التي تشبع التكافؤ الرئيسي هي التي توجد في المجال الشاردي (توصل بالكوبالت بخطوط غامقة اللون). التكافؤ الثانوي هو الذي تستخدمه جزيئات النشادر الست التي توجد في المجال التناسقي ، عدد التناسق (عدد الروابط التي تكونها المجموعات التناسقية مع شاردة المعدن المركزي) في هذه الحالة يساوي 6 ، إن كل جزيء من جزيئات النشادر الست يرتبط بذرة الكوبالت مباشرة برابطة إضافية (يمثلها خط فاتح اللون) . المجموعات التناسقية , جزيئات النشادر , حسب الفرض الثالث تأخذ اتجاهات محددة حول ذرة الكوبالت وبالتالي تكون على أبعاد معينة من الكوبالت , بينما شوارد الكلور الموجودة في المجال الشاردي لا ترتبط مباشرة بذرة الكوبالت , ولذلك تترسب هذه الشوارد بمجرد إضافة نترات الفضة إلى المحلول .
تُسمى جزيئات النشادر المرتبطة مباشرة مع الكوبالت بمجموعات تناسقية أو مرتبطات. وهكذا يُمكن كتابة المعقد CoCl3.6NH3 على الشكل Co(NH3)6]Cl3] ، ويرسم كما يلي:
أما المعقد (CoCl3.5NH3) فيرسم كما في الشكل:
إن شوارد الكلور الثلاثة تشبع التكافؤ الرئيسي للكوبالت , ويلاحظ في هذا المعقد وجود خمسة جزيئات نشادر فقط , ولكن لأن العدد التناسقي للكوبالت هو 6 , لذلك فإن أحد شوارد الكلور لابد أن يشبع التكافؤ الثانوي الناقص , بالإضافة لإشباع التكافؤ الرئيسي , هذه الشاردة إذن تقوم بدور مزدوج , ولذلك وبحسب فيرنر فإنه يتصل بالكوبالت بواسطة خطان : احدهما فاتح اللون , كما انه يوجد في المجال التناسقي . شاردة الكلور هذه لا تترسب مباشرة بإضافة محلول نترات الفضة , كـمـا أن الشاردة المعقدة +CoCl(NH3)5]2] تحمل شحنة تساوي (+2) وذلك لان مجموع الشحنات فيها هي Cl- + Co3+ = +3 (-1)= +2 , وتصبح صيغة المعقد CoCl(NH3)5]Cl2]، إن إضافة نترات الفضة بالتالي على محلول هذا المعقد ترسب شاردتي الكلور الموجودتين خارج القوس أي في المجال الشاردي .
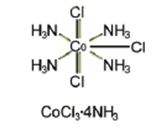
أما المعقد (CoCl3.4NH3) , فانه يرسم بحساب فيرنر كما في الشكل:
حيث شاردتي كلور تشبعان التكافؤ الرئيسي والتكافؤ الثانوي في الوقت نفسه , ومن ثم فإنهما توجدان في المجال التناسقي . هذا المعقد يتشرد في المحلول إلى شاردتين هما : شاردة الكلور -Cl , والشاردة المعقدة +[Co(NH3)4Cl2] وبالتالي فان إضافة نترات الفضة إلى هذا المحلول ترسب كلور الفضة (Ag Cl) يكافئ شاردة كلور واحد فقط . حسب الفرض الثالث تأخذ المرتبطات اتجاهات محددة حول ذرة الكوبالت وبالتالي تكون على أبعاد معينة من الكوبالت , بينما شوارد الكلور الموجودة في المجال الشاردي لا ترتبط مباشرة بذرة الكوبالت , ولذلك تترسب هذه الشوارد بمجرد إضافة نترات الفضة إلى المحلول .
لقد لاحظ فيرنر وجود مركبين لهما نفس الصيغة الجزيئية (Moleculor formula) أو التكوين الكيميائي Chemical composition ) [Co(NH3)4Cl2]Cl) ويختلفان في الخواص الفيزيائية والكيميائية ، أحدهما أخضر والآخر بنفسجي.
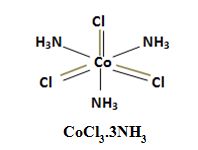
أما بحسب نظرية فيرنر فان المعقد (CoCl3.3NH3) يكون تركيبه كما في الشكل:
وتكون صيغته هي [CoCl3(NH3)3] , وهكذا فانه من المتوقع ألا يعطي شوارد كلور في المحلول , ومن ثم فإن إضافة نترات الفضة إلى المحلول لا ترسب أي كلور فضة .
إن نظرية فيرنر لم تفسر طبيعة الرابطة في المعقَّدات وأخفقت في تعليل خواصها المختلفة. إلاَ أنه بعد إيجاد نظرية الروابط للعالم لويس عام 1916 ، وصّف العالم سيدويك Sidgwick الروابط الإضافية في نظرية فيرنر بأنها ليست إلاّ روابط تساندية .
إضافة تعليق
التعديل الأخير تم: 18/08/2021






Comments (1)
1. Morad (link) 06/05/2018
<h1>جميل</h1>