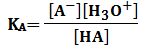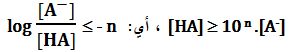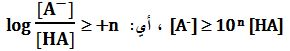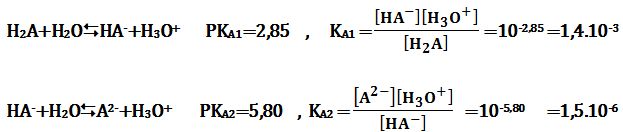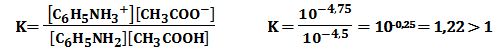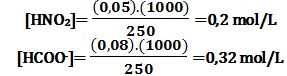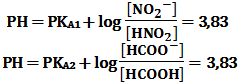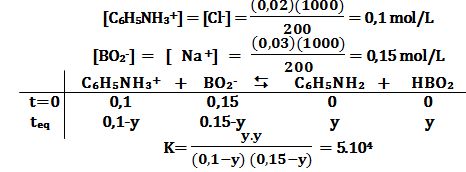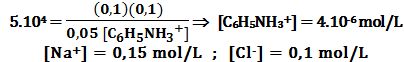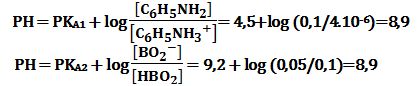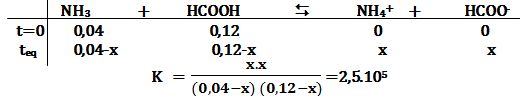مخطط الرجحان لزوج حمض-أساس مرافق Predominance diagram of conjugate acid/base pair
مخطط الرجحان لزوج حمض-أساس مرافق
: حيث HA/A- ليكن الزوج حمض ـ أساس مرافق
HA+H2O ↔ A-+H3O+
: إن ثابت التشرد للتوازن
HA+H2O↔A-+H3O+
: هو
PKA = - logKA المحلول بدلالة PH ويُمكن بسهولة حساب
تُسمى هذه بعلاقة Henderson-Hasselbalch .
يُمكن دراسة الحالات التالية:
1ـ عندما تكون تراكيز الشكل الحمضي والأساسي في المحلول متساوية: [A-] = [HA]
تؤول علاقة Henderson-Hasselbalch إلى العلاقة:
PH=PKA
وهي توافق أن يكون الشكلان الحمضي والأساسي راجحين في المحلول.
2ـ عندما يكون تركيز الشكل الأساسي -A مهملاً بالمقارنة مع تركيز الشكل الحمضي HA يكون:
وتؤول علاقة Henderson-Hasselbalch إلى المتراجحة التالية:
PH ≤ PKA – n ، وهي توافق أن يكون الشكل الحمضي راجحاً في المحلول.
3ـ عندما يكون تركيز الشكل الحمضي HA مهملاً بالمقارنة مع تركيز الشكل الأساسي -A يكون:
وتؤول علاقة Henderson-Hasselbalch إلى المتراجحة التالية:
PH ≥ PKA+n ، وهي توافق أن يكون الشكل الأساسي راجحاً في المحلول.
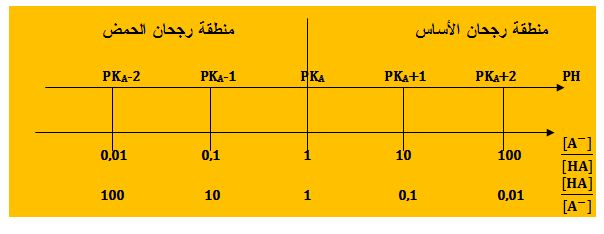
ويتحددمخطط الرجحان برسم محوراً PH وتعيين عليه قيم PKA الموافقة لقيم مختلفة
للنسبة [-HA] / [A] أو [A-] / [HA]
تمرين ـ يُعتبر حمض المالونيك HOOCCH2COOH حمضاً ثنائي الوظيفة H2A ويتميز بالثابتين PKA1=2,85 و PKA2=5,80.
1ـ اكتب المعادلتين المحصلتين لتفاعل كل من H2A و -HA مع الماء، ثم استنتج منهما عبارتي KA1 و KA2. ارسم مخطط الرجحان للجزئيات والشوارد الداخلة في التفاعلين أو الناجمة عنهما.
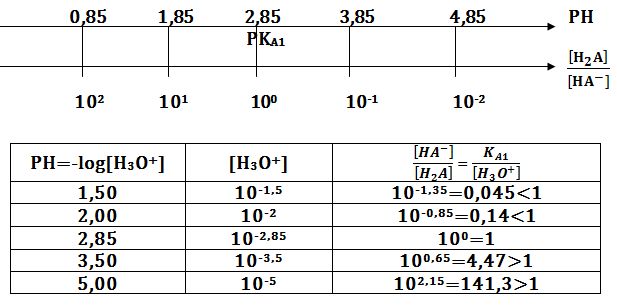
2ـ احسب النسبة HA-]/[H2A]=x] وذلك عندما : PH=1,50 ; 2,00 ; 2,85 ; 3,50 ; 5,00 ماذا تستنتج؟
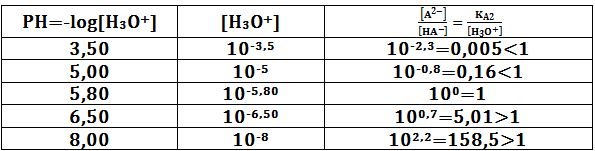
3ـ احسب النسبة A2-]/[HA-]=y] وذلك عندما: PH=3,50 ; 5,00 ; 5,80 ; 6,50 ; 8,00
ماذا تستنتج؟
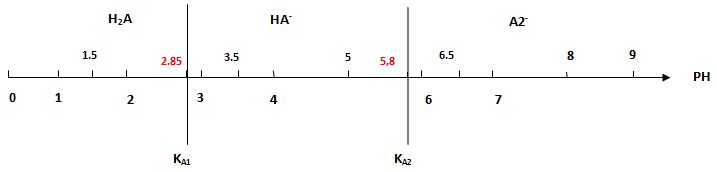
4ـ استنتج من الطلبين السابقين تركيب المحلول عندما يكون الـ PH=3,5
من أجل PH=2,85 يكون التفاعل متوازناً،
ومن أجل PH<2,85 يكون التفاعل منزاحاً نحو اليسار،
أما من أجل PH>2,85 يكون التفاعل منزاحاً نحو اليمين.
من أجل PH=5,80 يكون التفاعل متوازناً،
ومن أجل PH<5,80 يكون التفاعل منزاحاً نحو اليسار،
أما من أجل PH>5,80 يكون التفاعل منزاحاً نحو اليمين.
عندما PH=3,5 فالتفاعل الأول يكون منزاحاً نحو اليمين (-HA) والثاني منزاحاً نحو اليسار (-HA)
يُمكن رسم على محور افقي قيم PH المختلفة الواردة في الطلبين 2 و3، وبالإستفادة من المناقشات السابقة يُمكن وضع الشوارد المختلفة على هذا المحور.
أي أن تركيب المحلول من أجل PH=3,5 هو -HA و +H3O .
تمرين ـ لتكن قيم PKA للأزواج حمض/أساس التالية:
PKA (HNO2/NO2-) =3,20 ; PKA (C6H5NH3+/ C6H5NH2) =4,50
PKA (NH4+/ NH3) =9,20 ; PKA (CH3COOH/ CH3COO-) =4,75
حدد على محور شاقولي مناطق الرجحان لكل من الشكلين الحمضي والأساسي للأزواج السابقة
ثم اكتب التفاعل المحصل واحسب ثابت توازنه لكل من
حمض الخل مع الأنيلين
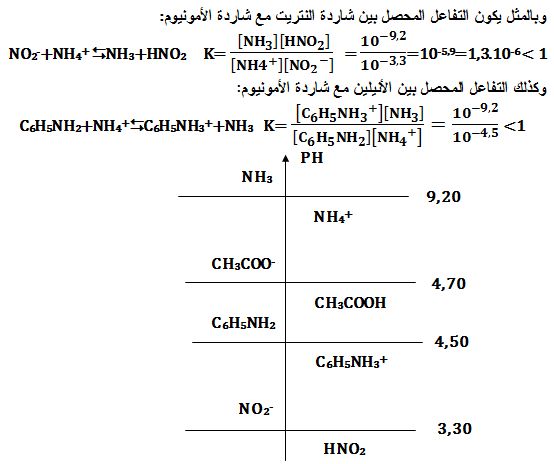
شاردة النتريت مع شاردة الأمونيوم
ثم الأنيلين مع شاردة الأمونيوم
الزوج -CH3COOH/CH3COO
+CH3COOH +H2O↔CH3COO-+H3O
الزوج C6H5NH3+/C6H5NH2
C6H5NH2 + H3O+ ↔ C6H5NH3+ + H2O
ويتم الحصول على التفاعل المحصل بين حمض الخل مع الأنيلين ، بجمع التفاعلين السابقين:
CH3COOH+C6H5NH2 ↔ CH3COO- + C6H5NH3+
تمرين ـ يُحضر محلولاً بحجم 250cm3 وذلك بحل 0,05 مولاً من حمض الآزوتي مع 0,08 مولاً من نملات الصوديوم فإذا علمت أن:
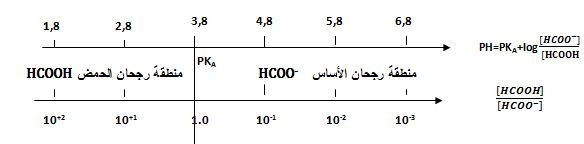
PKA (HNO2/NO2-) =3,30 , PKA (HCOOH/HCOO-) = 3,80 والمطلوب
ـ ارسم مخطط الرجحان لهذين الزوجين واكتب التفاعل الراجح واحسب ثابت توازنه
ـ اكتب جميع المعادلات المحصلة للتفاعلات التي يمكن أن تحدث واحسب ثابت توازنها. ماذا تستنتج؟
HCOO- أوجد التركيز النهائي لشاردة النملات
.المحلول PH ثم أعط قيمة تقريبية لـِ
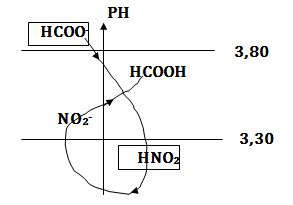
مخطط الرجحان للزوجين -HNO2/NO2:
مخطط الرجحان للزوجين -HCOOH/HCOO:
يوضع الزوجان على محور شاقولي PH اعتماداً على قيم PKA الموافقة لكل منهما
ثم يوضع إطاراً حول الجزيئات أو الشوارد المتفاعلة
يُلاحظ أن الأنواع الداخلة إلى المحلول HNO2 و -HCOO متواجدتان في مناطق رجحان متباينة
يُمكن التنبؤ بالتفاعل الراجح بين الأساس الأقوى -HCOO مع الحمض الأقوى HNO2 وفق قاعدة γ وأن ثابت توازن تفاعلهما معاً أكبر من الواحد.
-HNO2 + HCOO- ↔ HCOOH + NO2
حساب التراكيز عند المزج (بعد التمديد):
وبافتراض التفاعل الافتراضي الراجح:
HNO2 + HCOO- ↔ NO2- + HCOOH
الأساس الأقوى الحمض الأقوى
فإن ثابت توازنه K :
وتُحسب التراكيز التوازنية لمكونات المحلول اعتماداً على هذا التفاعل:
[HNO2]=0,2-0,155=0,045 mol/L
[HCOO-]=0,32-0,155=0,165 mol/L
[NO2-] = [HCOOH] = 0,155 mol/L
وبهذا يتألف المحلول المائي من الجزيئات والشوارد:
HCOOH, NO2- , HNO2, HCOO- , H3O+ ,OH-
حيث -H3O+ , OH هي من التحليل البروتوني الذاتي للماء .
يُمكن كتابة تفاعلات أُخرى تجري في المحلول المائي واثبات أنها مهملة أمام التفاعل الافتراضي الراجح:
HNO2+ H2O↔NO2- + H3O+ KA1=10-3,3<100,5
HCOOH+H2O↔HCOO- +H3O+ KA2=10-3,8<100,5
HCOOH+HCOO- ↔ HCOO- +HCOOH K3=1
HNO2+ NO2- ↔ NO2- +HNO2 K4=1
يُمكن حساب K5 بضرب طرفي العلاقة K5 بـِ [+H3O+]/[H3O]
فيكون:
K5=10-14 KA2=10-10,2<100.5
يُمكن حساب K6 بضرب طرفي العلاقة K6 بـِ [+H3O+]/[H3O]
فيكون:
K6=10-14 KA1=10-10,7<100.5
إن التفاعلين الثالث والرابع لا يُغيران من تركيب المحلول، أما بقية التفاعلات فهي مهملة أمام التفاعل الافتراضي وذلك لصغر ثوابت توازنها التوازنية أمام ثابت التوازن للتفاعل الافتراضي الذي يُمكن اعتباره التفاعل الراجح. ويكون التركيب النهائي للمحلول:
[HNO2]=0,2-0,155=0,045 mol/L ; [HCOO-]=0,32-0,155=0,165 mol/L
[NO2-] = [HCOOH] = 0,155 mol/L ; [Na+]=0,32 mol/L
يُمكن حساب PH المحلول باستخدام أحد الزوجين -HNO2/NO2 أو -HCOOH/HCOO من أحد العلاقتين:
تمرين ـ يُحل 0,02 مول من كلور الأنيلينيوم C6H5NH3+Cl- , PKA=4,50
و 0,03 مول من بورات الصوديوم Na+BO2- , PKA=9,20
في 200cm3 من الماء المقطر.
حدد على محور شاقولي مناطق الرجحان لمركبات الأزواج حمض/أساس الواردة في التمرين،
واكتب المعادلة المحصلة للتفاعل الراجح وحدد ثابت توازنه. ماذا تستنتج؟
ثم اكتب المعادلات المحصلة الأخرى للتفاعلات التي يمكن أن تحدث في المحلول،
وحدد ثوابت توازنها، ماذا تستنتج؟
وأخيراً حدد التراكيز النهائية للجزئيات والشوارد المتواجدة في المحلول ثم أوجد قيمة تقريبية لـِ PH المحلول .
-C6H5NH3+Cl- → C6H5NH3+ + Cl
C6H5NH3+ + H2O ↔ C6H5NH2 + H3O+ PKA1 =4.5
C6H5NH3+ / C6H5NH2
-Na+BO2- → Na+ + BO2
HBO2 + H2O ↔ BO2- + H3O+ PKA2 =9.2
HBO2 / BO2-
التفاعل تام أو شبه تام → K = KA1/KA2 = 104,7 = 50119 ≈ 5.104 >>1
C6H5NH3+ + H2O ↔ C6H5NH2 + H3O+ PKA1 =4,5
HBO2 + H2O ↔ BO2- + H3O+ PKA2 =9,2
C6H5NH3+ + C6H5NH2 ↔ C6H5NH2 + C6H5NH3+ PKA4 =1
HBO2 + BO2- ↔ BO2- + HBO2 PKA5=1
يُلاحظ أن التفاعلين الرابع والخامس لا يُغيران من تركيب المحلول، أما بقية التفاعلات فهي مهملة أمام التفاعل الثالث، الأمر الذي يسمح باعتباره التفاعل الراجح.
وبحل هذه المعادلة من الدرجة الثانية بالنسبة إلى المتحول y يُمكن إيجاد y1≈0,1 وهو حل مقبول و y2≈0,15 وهو حل مرفوض. يُلاحظ أن كل شوارد الأنيلينيوم +C6H5NH3 قد تفاعلت تقريباً بسبب ثابت التوازن الكبير. وتكون بالتالي التراكيز في حالة التوازن:
[C6H5NH3+] → (0,1-0,1) → ε mol/L
[BO2-] = 0.15-0,10=0,05 mol/L
[C6H5NH2] = [ HBO2 ] = 0,1 mol/L
ويُمكن حساب [+ε =[C6H5NH3 من علاقة ثابت التوازن:
ويُمكن حساب PH المحلول من أحد العلاقتين:
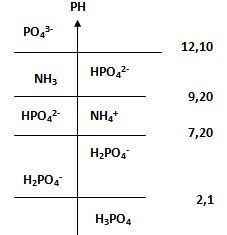
تمرين ـ تُحضر ثلاثة محاليل مائية كل منها بحجم واحد ليتر وذلك عن طريق حل 0,1 مول من كل من ثاني هيدروجين فوسفات الأمونيوم NH4H2PO4، هيدروجين فوسفات الأمونيوم NH4)2HPO4) وفوسفات الأمونيوم NH4)3PO4). فإذا علمت أن قيمة PKA لشاردة الأمونيوم تساوي 9,20 أن قيم PKAi لحمض الفوسفور هي: PK3 =12,10; PK2 =7.20; PK1 =2,15. ارسم مخططات الرجحان لجميع الشوارد والجزئيات، ثم اكتب بالنسبة لكل محلول من المحاليل الثلاثة المعادلة المحصلة للتفاعل الكيميائي بين المواد الداخلة في تركيب المحلول واحسب ثابت توازنه.
H3PO4 + H2O ↔ H2PO4- + H3O+ PK1 =2,15
H2PO4-+ H2O ↔ HPO42- + H3O+ PK2 =7.20
HPO42-+ H2O ↔ PO43- + H3O+ PK3 =12,10
NH4+ + H2O ↔ NH3 + H3O+ PK4 = 9,20
H2PO4-+ NH4+ ↔ H3PO4 + NH3 K5 =K4/K1 = 10-7,05
HPO42-+ NH4+ ↔ H2PO4- + NH3 K6 =K4/K2 = 10-2
PO43-+ NH4+ ↔ HPO42- + NH3 K7 =K4/K3 = 102,9
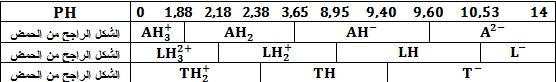
تمرين ـ يحتوي محلول مائي على مزيج من ثلاثة حموض أمينية التالية:
Tryptophan ويُرمز له بـِ T ، ثنائي الوظيفة ( PK1=2,38، PK2=9,40)،
يُشكِل في المحلول المائي الأشكال التالية: -TH2+ → TH → T
Acid Aspartique ويُرمز له بـِ A، ثلاثي الوظيفة : وظيفتين -COOH وأُخرى NH2
PK1= 1,88, PK2= 3,65, PK3=9,60،
يُشكِل في المحلول المائي الأشكال التالية:
-AH3+ → AH2 → AH- → A2
Lysine ويُرمز له بـِ L ، ثلاثي الوظيفة : وظيفتين -NH2 وأُخرى COOH
PK1=2,18, PK2= 8,95, PK3=10,53،
يُشكِل في المحلول المائي الأشكال التالية:
-LH32+ → LH2+ → LH → L
بمساعدة الجدول التالي:
|
14 0 |
PH |
|
|
الشكل الراجح من الحمض A |
|
|
الشكل الراجح من الحمض L |
|
|
الشكل الراجح من الحمض T |
1ـ اكتب المخططات الشكلية للتبادل البروتوني الموافقة للأشكال الراجحة للحموض الأمينية الثلاثة. ثم حدد من أجل كل حمض من الحموض الثلاثة مناطق PH التي يتواجد فيها الشكل الراجح بشكل رئيسي.
2ـ برهن بمساعدة الجدول السابق، أنه يوجد منطقة من PH تكون فيها الأشكال الراجحة من الحموض الثلاثة لها شحنات مختلفة (موجبة، سالبة، حيادية)، وحدد هذه الأشكال.
3ـ من أجل كل حمض من الحموض الثلاثة حدد بشكل خاص قيم PH التي من أجلها يكون الشكل الراجح هو على الأقل 100 مرة أكثر تركيزاً من الأشكال الأخرى.
4ـ برهن أن نتائج الطلب 3 تُعرَّف منطقة من PH حيث يكون الشرط محققاً من أجل الحموض الثلاثة معاً.
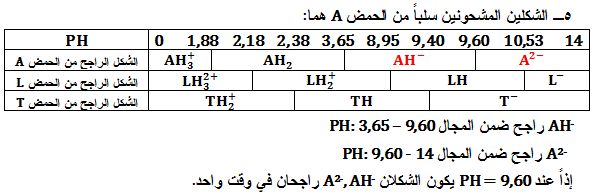
5ـ يُفترض الآن محلولاً يحوي فقط الحمض (A)، وله قيمة PH بحيث أن الشكلين المشحونين سلباً هما الراجحان معاً (في آن واحد)، ما هي قيمة المجال PH التي تتحقق فيها هذه الظاهرة ؟
1ـ تُكتب التفاعلات حمض ـ أساس الموافقة:
ويُستنتج جدول الرجحان:
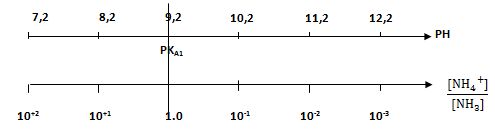
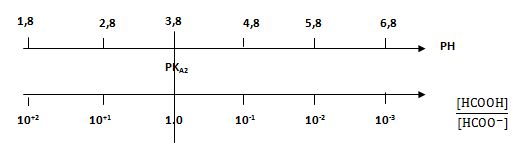
تمرين ـ يُحضر 250cm3 من محلول وذلك بحل 0,01mol من النشادر مع 0,03mol من حمض النمل.
فإذا علمت أن : PKA (NH4+/NH3) =9,2 ; PKA (HCOOH/HCOO-) =3,80
والمطلوب رسم مخطط الرجحان للزوجين بدلالة PH والنسبة [-HA]/[A] وكتابة المعادلةات المحصلة لجميع التفاعلات وتحديد ثوابت توازنها، ثم استنتج المعادلة المحصلة للتفاعل الراجح وإيجاد التركيب النهائي للمحلول وأخيراً حساب قيمة PH المحلول.
مخطط الرجحان للزوجين NH4+/NH3
ومخطط الرجحان للزوجين -HCOOH/HCOO
إن تركيز كل من النشادر وحمض النمل في المحلول يُساوي:
[NH3]=(0,01) . 4=0,04 mol/L , [HCOOH] = (0,03) . 4=0,12 mol/L
إن ثابت توازن التفاعل -NH3+HCOOH↔NH4+ + HCOO يُساوي:
وهو تفاعل راجح تام يجري بين الحمض الأقوىHCOOH والأساس الأقوى NH3.
لإيجاد التركيب النهائي للمحلول يتم في البدء حساب التراكيز التوازنية لمكونات المحلول استناداً إلى التفاعل الراجح وثابت توازنه كما يلي:
وبحل هذه المعادلة من الدرجة الثانية بالنسبة للمتحول x ، يُمكن إيجاد x1≈0,04mol/L وهو حل مقبول وx2≈0,12mol/L وهو حل مرفوض.
وبسبب ثابت التوازن الكبير يُلاحظ أن كل جزيئات النشادر تقريباً قد تفاعلت وتكون بالتالي قيم التراكيز في حالة التوازن :
[NH3]→ε mol/L , [HCOOH] ≈0,08 mol/L
[NH4+] ≈ 0,04 mol/L , [HCOO-] ≈ 0,04 mol/L
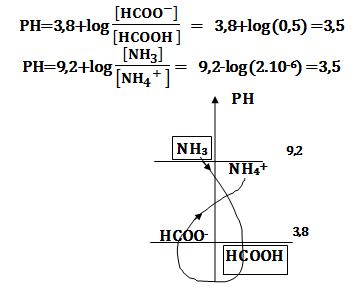
ولكن يُمكن بتقريب حساب تركيز النشادر [ε=[NH3 من علاقة ثابت التوازن:
وبذلك يتألف المحلول من الجزيئات والشوارد التالية: +HCOOH , HCOO-, NH4 بالإضافة إلى +H3O و -OH الناتج من الزوج H2O/H2O .
يُمكن حساب PH المحلول باستخدام أحد الزوجين NH4+/NH3 أو -HCOOH/HCOO من إحدى العلاقتين :
إضافة تعليق
التعديل الأخير تم: 11/07/2021