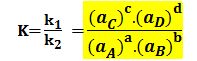قانون فعل الكتلة The law of mass action
قانون فعل الكتلة The law of mass action
عندما تصبح الكتل النسبية لمادتين متفاعلتين A و B ثابتة، يُقال أنه قد حصل توازن أو أن تفاعل المادة A مع المادة B قد أصبح متوازناً. وعندما يكون باستطاعة نواتج التفاعل C و D مثلاً من التفاعل مع بعضها البعض معطية المواد المتفاعلة A و B ، يُقال أن التفاعل عكوس ويُكتب عادة على الشكل التالي:
aA + bB ↔ cC + dD
إن التوازن السابق هو توازن حركي (ديناميكي) وليس سكوني، بمعنى أن A و B يستمران في التفاعل لتشكيل C و D اللتين يتفاعلان لإعطاء A و B ثانية حتى استتباب حالة التوازن، إلاَ أن الكمية التي تستهلك من A ومن B في زمن معين تساوي إلى الكمية المتشكلة من هاتين المادتين بنتيجة تفاعل C و D وبعبارة أخرى إن سرعة تفاعل A و B بعد الوصول إلى حالة التوازن مساوياً إلى سرعة تفاعل C مع D .
يُعبر عن سرع التفاعلات هذه بقانون فعل الكتلة للعالمين Cato Guldberg وPeter Waage الذي ينص على أن سرعة تفاعل ما يتناسب طرداً مع التراكيز الفعالة للمواد المتفاعلة، كل تركيز منها مرفوع إلى قوة عددية مساوية لعدد الجزيئات الظاهرة في معادلة التفاعل الموازنة.
فإذا كانت v1 هي سرعة تفاعل المادة A مع المادة B في التفاعل aA + bB ↔ cC + dD
فإنه وحسب قانون فعل الكتلة يُمكن كتابة v1 :
v1=k1(aA)a.(aB)b
وإذا كانت v 2 هي سرعة تفاعل المادة C مع المادة D في التفاعل، فإنه يُمكن كتابة v2:
v2=k2( aC)c.(aD)d
حيث k1 و k2 ثابتتين .
عند استتباب حالة التوازن تُصبح v1=v2 أي:
k1(aA)a.(aB)b = k2( aC)c.(aD)d
يُدعى الثابت K بثابت التوازن وهو ثابت ما دامت درجة الحرارة ثابتة.
يُمكن تعريف حاصل التفاعل (Reaction quotient) للتفاعل: aA + bB ↔ cC + dD بأنها النسبة:
إن النسبة Q ليس لها واحدة وتتعلق بقيم فعاليات المواد ضمن المحلول وكذلك درجة حرارة المحلول.
تتصرف المحاليل الحقيقية وكأنها محاليل مثالية عندما تكون تراكيزها صغيرة،ويُمكن القبول بأن:
تُعرف فعالية مادة بأنها المقدار الذي يؤدي وضعه بدلاً من التركيز في المعادلات الخاصة بالجمل المثالية إلى جعل هذه المعادلات تنطبق على المحاليل المدروسة.
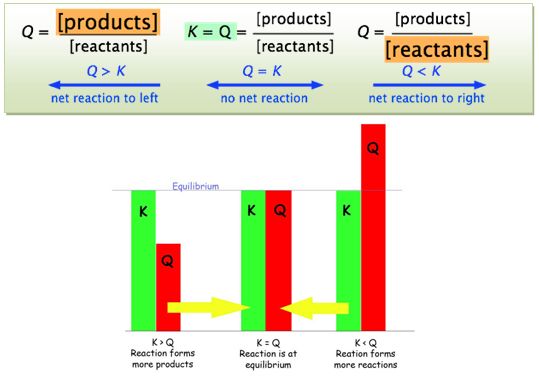
عندما يصل التفاعل إلى حالة التوازن، فإن حاصل التفاعل Q يأخذ قيمة ثابتة، هي ثابت توازن التفاعل K:
يُمكن صياغة قانون فعل الكتلة لأي تفاعل متوازن بشكل عام كما يلي:
إن حاصل نسبة جداء فعاليات المواد المتوازنة في طرفي التفاعل الكيميائي المتوازن مرفوعة لقوى مناسبة تساوي إلى عدد ثابت يُدعى ثابت التوازن.
يُمكن استخدام حاصل التفاعل Q للتنبؤ بجهة التفاعل نحو التوازن، ويُمكن التمييز بين حالتين:
أـ Q>K : تكون كميات النواتج أكبر من كمياتها المتواجدة في حالة التوازن، وسيحتاج التفاعل لإنتاج كميات أخرى من المتفاعلات مزيحاً بذلك التفاعل باتجاه اليسار.
ب ـ Q<K : تكون كميات المتفاعلات أكبر من كمياتها المتواجدة في حالة التوازن، وسيحتاج التفاعل لإنتاج كميات أخرى من النواتج مزيحاً بذلك التفاعل باتجاه اليمين.
تُستخدم قاعدة لوشاتولييه – فانت هوف Le chatelier-Van't Hoff لتعيين تأثير أحد متحولات الحالة ( تغيير الضغط ، تغيير الحجم أو تغيير درجة الحرارة) أو التركيز على التوازن الكيميائي :
إذا حدثت تغييرات في التركيز،أو درجة الحرارة، أو الحجم، أو الضغط الجزئي لأحد المواد في نظام كيميائي موجود في حالة توازن كيميائي فعندها سيتغير التوازن الكيميائي في الاتجاه الذى يُحد من تأثير هذا التغيير.
وللتبسيط سوف لن يُكتب الرمز eq بحيث يُستعمل الرمز [B] مثلاً للتعبير عن تركيز المادة B (بواحدة mol/L ) في المحلول في حالة التوازن .
إضافة تعليق
التعديل الأخير تم: 02/07/2021