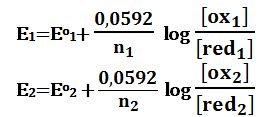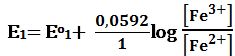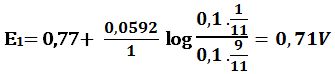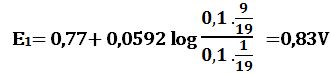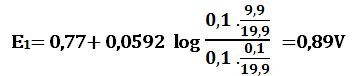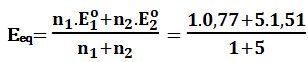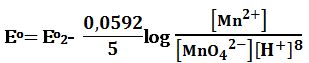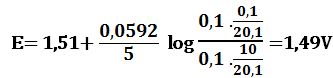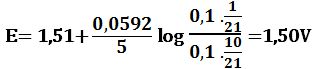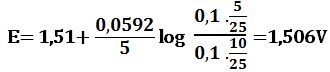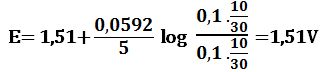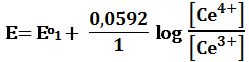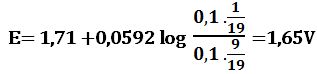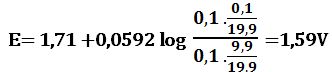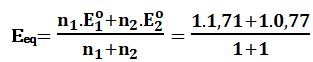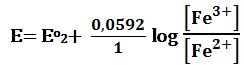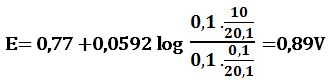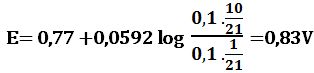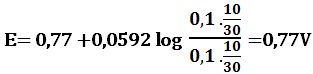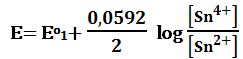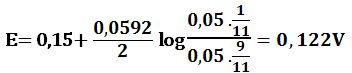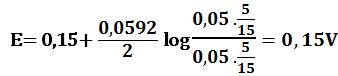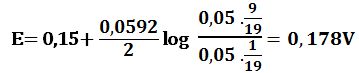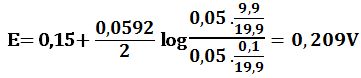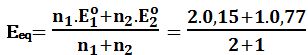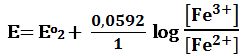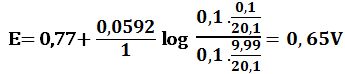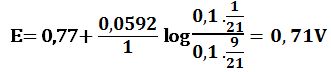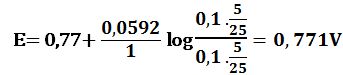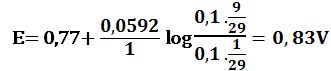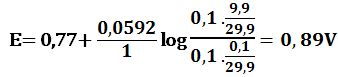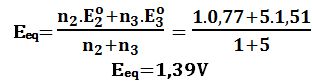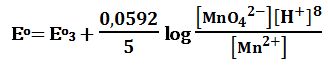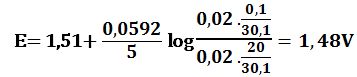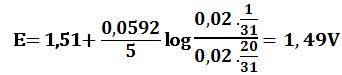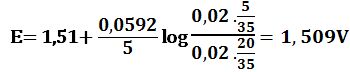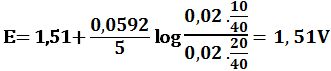رسم منحنيات المعايرة بالأكسدة والإرجاع نظرياً Theoretical plotting of oxidation-reduction titration curves
رسم منحنيات المعايرة بالأكسدة والإرجاع نظرياً
تمثل منحنيات المعايرة بالأكسدة والإرجاع تغير كمون المحلول بدلالة حجم المحلول العياري المضاف (E=f(V.
ولدراسة منحني المعايرة عملياً يغمس في المحلول المدروس مسريين( بلاتين ومقارن) يتصلان بمقياس للكمون يسمح بتحديد تغير كمون المحلول بتغير حجم المحلول العياري المستخدم خلال المعايرة.
لدى إضافة جسم مؤكسد (Eo كبيرة) إلى جسم مرجع ( Eo صغيرة) فإن كمون المحلول المعاير (الجسم المرجع) يزداد ببطء في البداية حتى يصل إلى قيمة كمون نقطة التكافؤ حيث يرافقها ازدياد حاد ومفاجئ في كمون المحلول.
ويحدث العكس لدى إضافة جسم مرجع إلى جسم مؤكسد حيث يتناقص ببطء كمون المحلول المعاير (الجسم المؤكسد) حتى يصل إلى قيمة كمون نقطة التكافؤ التي يرافقها تناقص حاد ومفاجئ في كمون المحلول. يتناقص من بعدها الكمون ببطء بازدياد الكمية المضافة من الجسم المرجع.
يحدد حجم المحلول العياري اللازم للوصول إلى نقطة التكافؤ من القفزة في كمون المحلول المرافقة لنقطة التكافؤ وذلك بشكل مماثل لمنحنيات المعايرة بالتعديل (حمض ـ أساس).
تُساهم دراسة منحنيات المعايرة بالأكسدة والإرجاع النظرية في حسن اختيار مشعر الأكسدة والإرجاع المناسب للمعايرة والذي يجب أن يكون مجال تغير لونه واقعاً ضمن قفزة الكمون المرافقة لنقطة التكافؤ.
يحصل التفاعل التالي خلال معايرة الزوج ox1/red1 بالزوج ox2/red2:
تفاعل الأكسدة والإرجاع n2ox1+n1red2↔n2red1+n1ox2
حيث:
تفاعل إرجاع المؤكسد ox1
ox1+n1e- ↔ red1
تفاعل أكسدة المرجع red2
-red2 ↔ ox2+n2e
وعند كل إضافة من المحلول العياري تتغير تراكيز الأجسام المؤكسدة والمرجعة في المزيج
ويكون كمون كل زوج عند التوازن مساوياً إلى كمون المحلول:
E=E1=E2
وبما أن التفاعل متوازن فيحتوي المحلول خلال المعايرة في كل لحظة على جميع المركبات الداخلة والناتجة عن التفاعل.
ويمكن حساب كمون المحلول خلال مختلف مراحل المعايرة انطلاقاً من العلاقة E1 أو E2.
فخلال معايرة جسم مؤكسد (الزوج ox1/red1) بجسم مرجع (الزوج ox2/red2)
يُحسب كمون المحلول انطلاقاً من الثنائية التي تُعايَر (العلاقة E1) لأن تركيز ox2 في العلاقة E2 لا يكون محدداً ،
أما بعد تجاوز نقطة التكافؤ أي بوجود كمية فائضة ومحدودة من red2 فيحسب كمون المحلول انطلاقاً من الزوج المستخدم لإجراء المعايرة (العلاقة E2) لأن تركيز ox1 في العلاقة E1 لا يكون محدداً في هذه الحالة.
وبالمثل لدى معايرة جسم مرجع بجسم مؤكسد يُحسب كمون المحلول خلال المعايرة من زوج الجسم المرجع المدروس أما بعد تجاوز نقطة التكافؤ فيُحسب كمون المحلول من زوج الجسم المؤكسد المستخدم لإجراء المعايرة.
رسم منحني معايرة جسم مرجع بجسم مؤكسد نظرياً:
عند إضافة محلول مرجع إلى آخر مؤكسد يحدث تفاعل حتى الوصول إلى التوازن حيث يتساوى كمونا المحلولين.
تمرين ـ ارسم منحني معايرة 10cm3 من محلول لكبريتات الحديدي (الجسم المرجع +Fe2) تركيزه 0,1mol/L باستخدام برمنغنات البوتاسيوم (الجسم المؤكسد -MnO4) تركيزها 0,02mol/L في وسط من حمض الكبريت بحيث يكون H+]=1mol/L] . كرر ذلك باستخدام ثنائي كرومات بوتاسيوم -Cr2O72 بتركيز 0,1N .
أـ حالة برمنغنات البوتاسيوم : تتم التفاعلات النصفية التالية:
Fe2+ ↔ Fe3+ + e- Eo1=+0,77V
MnO4- + 8H+ + 5e-↔ Mn2+ + 4H2O Eo2 = +1,51V
يُحسب أولاً حجم برمنغنات البوتاسيوم اللازم للوصول إلى نقطة التكافؤ .
من التفاعلين النصفيين يتضح أن محلول +Fe2 الذي تركيزه 0,1mol/L يقابله نظامية مقدارها (1. 0,1 ) أي 0,1N
وإن محلول -MnO4 الذي تركيزه 0,02mol/L يقابله نظامية مقدارها (5 . 0,02) أي 0,1N أيضاً.
لذلك فإن قانون المعايرة يُعطي:
(-Fe2+) N1.V1 = N2.V2 (MnO4)
V2=Veq= =10cm3
يُحسب الآن كمون المحلول خلال المراحل التالية من المعايرة بغية إنشاء المنحني (E=f(V
قبل بدء المعايرة: لا يحوي المحلول المدروس سوى الزوج +Fe3+/Fe2 وبما أن تركيز +Fe3 (الناتجة عن الأكسدة الجزئية لـِ +Fe2 ) غير معلوم ،
لذلك لا يمكن تحديد الكمون قبل بدء المعايرة.
خلال المعايرة: يحسب كمون المحلول انطلاقاً من الزوج المعاير +Fe3+/Fe2 أي التفاعل :
Fe2+ ↔ Fe3+ + e- Eo1=+0,77V
ويعطى كمون المحلول تبعاً لعلاقة نرنست :
لدى إضافة 1cm3 من -MnO4 يتأكسد 1cm3 من +Fe2
وتتشكل بالمقابل كمية مكافئة من +Fe3
ويبقى في المزيج 9cm3 من +Fe2 في حجم إجمالي مقداره 11cm3 وبالتالي:
ولدى إضافة 5cm3 من -MnO4 يتأكسد 5cm3 من +Fe2 وتتشكل بالمقابل كمية مكافئة من +Fe3 ويبقى في المزيج 5cm3 من +Fe2 في حجم إجمالي مقداره 15cm3 وبالتالي:
ولدى إضافة 9cm3 من -MnO4 يتأكسد 9cm3 من +Fe2 وتتشكل بالمقابل كمية مكافئة من +Fe3 ويبقى في المزيج 1cm3 من +Fe2 في حجم إجمالي مقداره 19cm3 وبالتالي:
ولدى إضافة 9,9cm3 من -MnO4 يتأكسد 9,9cm3 من +Fe2 وتتشكل بالمقابل كمية مكافئة من +Fe3 ويبقى في المزيج 0,1cm3 من +Fe2 في حجم إجمالي مقداره 19,9cm3 وبالتالي:
عند نقطة التكافؤ: يُعطى كمون المحلول بالعلاقة:
Eeq=1,39V
بعد تجاوز نقطة التكافؤ: يحسب كمون المحلول انطلاقاً من الزوج +MnO4-/Mn2 المستخدمة لإجراء المعايرة التفاعل:
MnO4- + 8H+ + 5e- ↔ Mn2+ + 4H2O Eo2 = +1,51V
ويعطى كمون المحلول بالعلاقة:
حيث H+]=1mol/L] بالفرض
وكذلك كمية +Mn2 تبقى ثابتة لا تتغير بالمزيج بعد نقطة التكافؤ بسبب انتهاء التفاعل.
لدى تجاوز نقطة التكافؤ بمقدار %1 أي لدى وجود 0,1cm3 من -MnO4 بشكل فائض في المزيج يكون خطأ المعايرة %1+ وحجم المزيج 20,1cm3 :
لدى تجاوز نقطة التكافؤ بمقدار 10% أي لدى وجود 1cm3 من MnO4- بشكل فائض في المزيج يكون حجم المزيج 21cm3 :
لدى تجاوز نقطة التكافؤ بمقدار 50% أي لدى وجود 5cm3 من -MnO4 بشكل فائض في المزيج يكون حجم المزيج 25cm3 :
لدى تجاوز نقطة التكافؤ بمقدار 100% أي لدى وجود 10cm3 من -MnO4 بشكل فائض في المزيج يكون حجم المزيج 30cm3 :
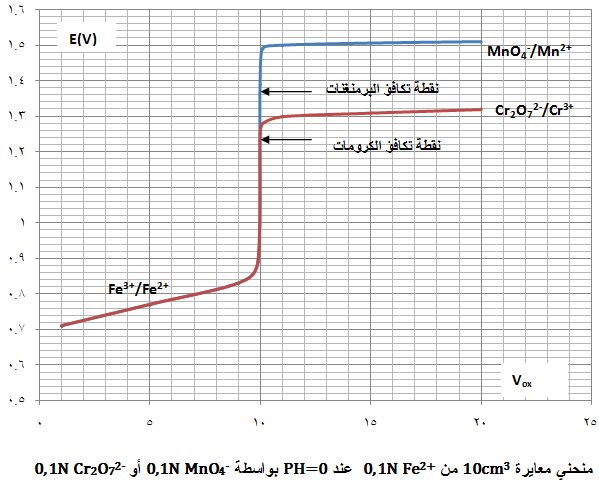
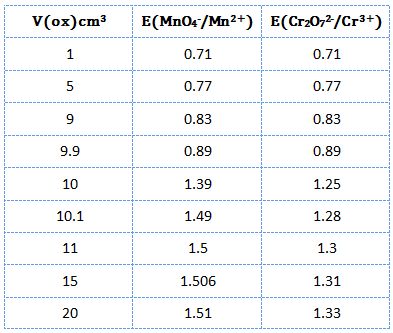
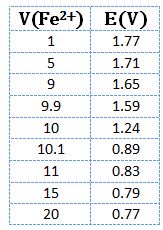
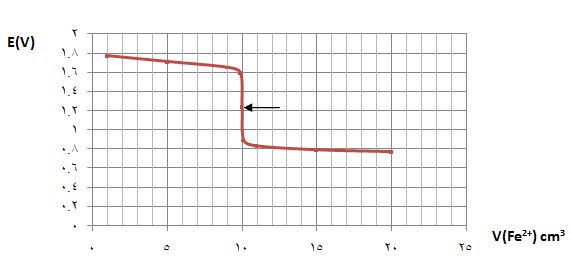
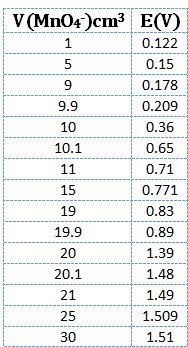
يُبين الشكل التالي منحني معايرة 10cm3 من كبريتات الحديدي 0,1N في وسط حمض الكبريت PH=0 باستخدام برمنغنات البوتاسيوم 0,1N .
يتضح من النتائج أن كمون المحلول عند نقطة التكافؤ يكون E= 1,39V
ويرافقها قفزة في كمون المحلول تمتد من E= 0,89V ولغاية E= 1,49V وذلك بخطأ مقدار %1± .
ب ـ حالة ثنائي كرومات البوتاسيوم : يُمكن إعادة الحسابات حيث تتم التفاعلات النصفية التالية:
Cr2O72--+14H++6e-↔2Cr3++7H2O
-6Fe2+ ↔ 6Fe3+ + 6e
يُبين الشكل السابق منحني المعايرة.
يتضح أن قيم كمون المحلول لا تتعلق بتركيز المواد المتفاعلة
لذلك فإن شكل المنحني وكذلك نقطة التكافؤ والقفزة المرافقة لها لا تتغير بتغير تركيز المواد المتفاعلة (عند PH=0).
هذا وتتعلق قيم كمون المحلول قبل نقطة التكافؤ فقط في الزوج المعاير +Fe3+/Fe2
ولا تتغير بتغير المحلول العياري المستخدم لإجراء المعايرة،
وبالعكس فإن قيم كمون المحلول بعد نقطة التكافؤ لا تتعلق سوى
بالزوج المعايِر (+MnO4-/Mn2 أو Cr2O72-/Cr3)
ولا تتغير بتغير المرجع المدروس.
يتضح كذلك أنه كلما كان الفرق بين الكمونات القياسية للمواد المتفاعلة كبيراً
Eo(Cr2O72-/Cr3+)=1,33V و Eo(MnO4-/Mn2+)=1,51V
كلما كانت قفزة الكمون المرافقة لنقطة التكافؤ كبيرة وبالتالي تزداد دقة المعايرة.
رسم منحني معايرة جسم مؤكسد بجسم مرجع نظرياً:
عند إضافة محلول مؤكسد إلى محلول مرجع ، بكمونات ابتدائية مختلفة يحدث تفاعل حتى الوصول إلى التوازن، حيث يتساوى كمونا المحلولين .
تمرين ـ ارسم منحني معايرة 10cm3 من محلول لشوارد السيريوم الرباعي +Ce4 (جسم مؤكسد) بمحلول لشوارد الحديد الثنائي +Fe2 (جسم مرجع) تركيز كل منها 0,1mol/L .
تحصل التفاعلات النصفية التالية:
Ce4+ + e- ↔ Ce3+ Eo1=1,71V
Fe2+ ↔ Fe3+ + e- Eo2=0,77V
وبما أن نظامية كل من المحاليل المتفاعلة متساوية ومساوية إلى ( 1. 0,1=0,1N )،
لذلك فإنها تتفاعل بحجوم متساوية،
ويكون حجم محلول +Fe2 اللازم للوصول إلى نقطة التكافؤ مساوياً إلى 10cm3 .
قبل بدء المعايرة:
لا يحوي المحلول المدروس سوى الزوج +Ce4+/Ce3 .
وبما أن تركيز +Ce3 (الناتجة عن الإرجاع الجزئي لـِ +Ce4 ) غير معلوم لذلك لا يمكن تحديد الكمون قبل بدء المعايرة.
خلال المعايرة: يُحسب كمون المحلول انطلاقاً من الزوج الذي يعاير أي +Ce4+/Ce3( التفاعل الأول) ويعطى تبعاً لعلاقة نرنست :
فلدى إضافة 1cm3 من +Fe2 يُرجع 1cm3 من +Ce4 وتتشكل بالمقابل كمية مكافئة من +Ce3 ويبقى في المزيج 9cm3 من +Ce4 في حجم إجمالي مقداره 11cm3 وبالتالي:
ولدى إضافة 5cm3 من +Fe2 يُرجع 5cm3 من +Ce4 وتتشكل بالمقابل كمية مكافئة من +Ce3 ويبقى في المزيج 5cm3 من +Ce4 في حجم إجمالي مقداره 15cm3 وبالتالي:
ولدى إضافة 9cm3 من +Fe2 يُرجع 9cm3 من +Ce4 وتتشكل بالمقابل كمية مكافئة من +Ce3 ويبقى في المزيج 1cm3 من +Ce4 في حجم إجمالي مقداره 19cm3 وبالتالي:
ولدى إضافة 9,9cm3 من +Fe2 يُرجع 9,9cm3 من +Ce4 وتتشكل بالمقابل كمية مكافئة من +Ce3 ويبقى في المزيج 0,1cm3 من +Ce4 في حجم إجمالي مقداره 19,9cm3 وبالتالي:
عند نقطة التكافؤ: يُعطى كمون المحلول بالعلاقة :
Eeq=1,24V
بعد تجاوز نقطة التكافؤ:
يحسب كمون المحلول انطلاقاً من الزوج +Fe3+/Fe2 المستخدمة لإجراء المعايرة (التفاعل الثاني) ويعطى بالعلاقة :
علماً بأن كمية +Fe3 لا تتغير بعد نقطة التكافؤ وتبقى ثابتة في المزيج بسبب انتهاء التفاعل.
لدى تجاوز نقطة التكافؤ بمقدار %1 أي لدى إضافة 0,1cm3 من +Fe2 بشكل فائض في المزيج يكون خطأ المعايرة %1+ ويصبح حجم المزيج 20,1cm3 :
ولدى تجاوز نقطة التكافؤ بمقدار 10% أي لدى إضافة 1cm3 من +Fe2 بشكل فائض في المزيج ويصبح حجم المزيج 21cm3 :
ولدى تجاوز نقطة التكافؤ بمقدار 50% أي لدى إضافة 5cm3 من +Fe2 بشكل فائض في المزيج ويصبح حجم المزيج 25cm3 :
ولدى تجاوز نقطة التكافؤ بمقدار 100% أي لدى إضافة 10cm3 من +Fe2 بشكل فائض في المزيج ويصبح حجم المزيج 30cm3:
يُستنتج مما سبق أن كمون المحلول عند نقطة التكافؤ E=1,24V ويرافقه انخفاض في كمون المحلول من القيمة 1,59V لغاية 0,89V وذلك بخطأ مقداره %1± .
ويُبين الشكل التالي منحني المعايرة .
يُلاحظ أن منحني معايرة جسم مؤكسد بآخر مرجع يعاكس منحني معايرة جسم مرجع بجسم مؤكسد.
رسم منحنيات معايرة المزائج بالأكسدة والإرجاع نظرياً:
لدى معايرة مزيج مؤكسدات بمرجع وحيد أو بالعكس معايرة مزيج مرجعات بمؤكسد وحيد فإن منحني المعايرة يحتوي على عدد من نقاط التكافؤ يساوي عدد مكونات المزيج المعاير.
تمرين ـ ارسم منحني معايرة مزيج من مادتين مرجعتين حجمه 10cm3 يحوي +Sn2 بتركيز 0,05mol/L و +Fe2 بتركيز 0,1mol/L بمحلول برمنغنات البوتاسيوم تركيزه 0,02mol/L في وسط من حمض الكبريت بحيث يكون PH=0 .
خلال المعايرة تحصل التفاعلات النصفية التالية:
Sn2+ ↔ Sn4+ + 2e- Eo1=0,51V
Fe2+ ↔ Fe3+ + e- Eo2=0,77V
MnO4- + 8H+ + 5e- ↔ Mn2+ + 4H2O Eo3 = 1,51V
إن المرجع الأقوى ( أي الذي يتميز باكمون القياسي الأصغر ) هو الذي يتأكسد أولاً ببرمنغنات البوتاسيوم
لذلك فإن +Sn2 تتأكسد أولاً
ثم تتأكسد +Fe2 .
إن نظامية كل من +Sn2 و +Fe2 تساوي:
N(Sn2+)=(2).(5.10-2)=0,1N
N(Fe2+)=(1).(0,1)=0,1N
بما أن النظاميات متساوية لذلك فإن حجم -MnO4 اللازم لمعايرة +Sn2 هو 10cm3 ولمعايرة +Fe2 هو 10cm3 أيضاً.
قبل بدء المعايرة:
لا يكون كمون المحلول محدداً لأن تركيز +Sn4 غير معلوم.
خلال معايرة:
يحسب كمون المحلول وكأنه الزوج +Sn4+/Sn2 بمفرده في المزيج:
فلدى إضافة 1cm3 من -MnO4 يتأكسد 1cm3 من +Sn2 وتتشكل بالمقابل كمية مكافئة من +Sn4 ويبقى في المزيج 9cm3 من +Sn2 في حجم إجمالي مقداره11cm3 وبالتالي:
ولدى إضافة 5cm3 من -MnO4 يتأكسد 5cm3 من +Sn2 وتتشكل بالمقابل كمية مكافئة من +Sn4 ويبقى في المزيج 5cm3 من +Sn2 في حجم إجمالي مقداره 15cm3 وبالتالي:
ولدى إضافة 9cm3 من -MnO4 يتأكسد 9cm3 من +Sn2 وتتشكل بالمقابل كمية مكافئة من +Sn4 ويبقى في المزيج 1cm3 من +Sn2 في حجم إجمالي مقداره 19cm3 وبالتالي:
ولدى إضافة 9,9cm3 من -MnO4 يتأكسد 9,9cm3 من +Sn2 وتتشكل بالمقابل كمية مكافئة من +Sn4 ويبقى في المزيج 0,1cm3 من +Sn2 في حجم إجمالي مقداره 19,9cm3 وبالتالي:
عند نقطة التكافؤ الأولى: يُعطى كمون المحلول بالعلاقة:
Eeq=0,36V
خلال معايرة +Fe2 :
يحسب الكمون حينئذ كما لو كان الزوج +Fe3+/Fe2 بمفدره في المزيج:
فلدى أكسدة 1% من +Fe2 تتشكل كمية مكافئة من +Fe3 ويبقى في المزيج 99% من +Fe2 في حجم إجمالي مقداره 20,1cm3 حيث يكون حجم -MnO4 المضاف حتى هذه اللحظة 10,1cm3 .
ولدى أكسدة 10% من +Fe2 تتشكل كمية مكافئة من +Fe3 ويبقى في المزيج 90% من +Fe2 في حجم إجمالي مقداره 21cm3 حيث يكون حجم -MnO4 المضاف حتى هذه اللحظة 11cm3
ولدى أكسدة 50% من +Fe2 تتشكل كمية مكافئة من +Fe3 ويبقى في المزيج 50% من +Fe2 في حجم إجمالي مقداره 25cm3 حيث يكون حجم -MnO4 المضاف حتى هذه اللحظة 15cm3
ولدى أكسدة 90% من +Fe2 تتشكل كمية مكافئة من +Fe3 ويبقى في المزيج 10% من +Fe2 في حجم إجمالي مقداره 29cm3 حيث يكون حجم -MnO4 المضاف حتى هذه اللحظة 19cm3
ولدى أكسدة 99% من +Fe2 تتشكل كمية مكافئة من +Fe3 ويبقى في المزيج 1% من +Fe2 في حجم إجمالي مقداره 29,9cm3 حيث يكون حجم -MnO4 المضاف حتى هذه اللحظة 19,9cm3 .
عند نقطة التكافؤ الثانية: يُعطى كمون المحلول بالعلاقة:
بعد تجاوز نقطة التكافؤ الثانية:
يحسب كمون المحلول انطلاقاً من الزوج +MnO4-/Mn2 كما لو كان بمفرده في المزيج .
حيث H+]=1mol/L] حسب الفرض،
وأن كمية +Mn2 تبقى ثابتة لا تتغير في المزيج بعد نقطة التكافؤ الثانية بسبب انتهاء التفاعل.
فبعد تجاوز نقطة التكافؤ الثانية بمقدار %1 أي لدى وجود 0,1cm3 من -MnO4 بشكل فائض في المزيج الذي يكون حجمه آنذاك30,1cm3 .
وبعد تجاوز نقطة التكافؤ الثانية بمقدار 10% أي لدى وجود 1cm3 من -MnO4 بشكل فائض في المزيج الذي يكون حجمه آنذاك31cm3 .
وبعد تجاوز نقطة التكافؤ الثانية بمقدار 50% أي لدى وجود 5cm3 من -MnO4 بشكل فائض في المزيج الذي يكون حجمه آنذاك35cm3 .
وبعد تجاوز نقطة التكافؤ الثانية بمقدار 100% أي لدى وجود 10cm3 من -MnO4 بشكل فائض في المزيج الذي يكون حجمه آنذاك40cm3 .
يُبين الشكل التالي مخطط المعايرة،
حيث يتضح أن الجزء من المنحني الذي يقع قبل نقطة التكافؤ الأولى يمثل
منحني معايرة +Sn2 بـ -MnO4 ولو كان المحلول يحوي فقط +Sn2 فإن منحني المعايرة يتابع منحاه وفق المنحني المتقطع من الشكل.
أما الجزء الذي يلي نقطة التكافؤ الأولى فيطابق
منحني معايرة +Fe2 ببرمنغنات البوتاسيوم كما لو كانت +Fe2 بمفردها في المزيج.
يُلاحظ دوماً أن قيم كمون المحلول لا يتعلق بتراكيز المواد المتفاعلة.
إضافة تعليق
التعديل الأخير تم: 15/07/2021