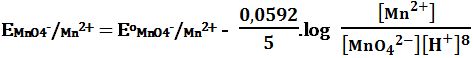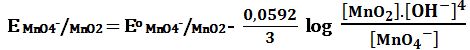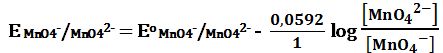تحديد نهاية المعايرة دون استخدام مشعر أو مؤكسد كمشعرDetermine the end of the titration without indicator or oxidizing agent as an indicator
تحديد نهاية المعايرة دون استخدام مشعر أو استخدام العامل المؤكسد كمشعر
يتم تحديد نهاية المعايرة دون استخدام مشعر عندما يكون لون الشكل المؤكسد لإحدى أزواج الأكسدة والإرجاع الداخلة في التفاعل مخالفاً للون شكلها المرجع.
ومن هذه الأزواج +MnO4-/Mn2 و +Ce4+/Ce3 .
تُرجَع شاردة البرمنغنات -MnO4 قرمزية اللون في الوسط الحمضي إلى شاردة المنغنيز +Mn2 عديمة اللون حسب التفاعل:
MnO4- + 8H+ + 5e-→ Mn2+ + 4H2O E1o = +1,51V
عديمة اللون لون قرمزي
ويُعبر عن كمون الأكسدة والإرجاع للتفاعل كما يلي:
يتضح أن +EMnO4-/Mn2 يتعلق كثيراً بـِ [H+] .
فعند معايرة شاردة الحديدي +Fe2 بمحلول عياري لبرمنغنات البوتاسيوم في وسط حمضي يحدث التفاعل:
5Fe2+ +MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O
وبما أن شاردة المنغنيز +Mn2 الناتجة عن تفكك البرمنغنات عديمة اللون
فإنه يُمكن تحديد نقطة نهاية المعايرة دون استخدام أي مشعرلأن زيادة ولو قطرة واحدة من البرمنغنات المضافة إلى محلول شاردة الحديدي المطلوب معايرته
تؤدي إلى ظهور اللون القرمزي الدال على نقطة التعادل.
وكذلك فإن لشاردة السيريوم الرباعي +Ce4 لوناً شديد الاصفرار وهي تُرجَع إلى شاردة السيريوم الثلاثي +Ce3 عديمة اللون بوجود شاردة الحديدي +Fe2 وفق ما يلي:
-Fe2+ ↔ Fe3+ + e
+Ce4+ + e- ↔ Ce3
عديم اللون أصفر شديد
ويُمكن تحديد نقطة نهاية معايرة شوارد الحديدي بكبريتات السيريوم Ce(SO4)2 دون استخدام أي مشعر إذ أن زيادة ولو بقطرة واحدة من كبريتات السيريوم تؤدي إلى اختفاء اللون الأصفر الشديد ويصبح المحلول عديم اللون دالاً على نقطة التعادل.
ملاحظة:
في الأوساط ضعيفة الحموضة أو القلوية فإن شاردة البرمنغنات -MnO4 تُرجَع إلى MnO2 كما يلي:
MnO4- +2H2O + 3e-↔ MnO2(s) + 4OH- E2o = +0,57V
أما في الأوساط شديدة القلوية فإن شاردة البرمنغنات -MnO4 تُرجَع إلى -MnO42 كما في التفاعل:
MnO4- + e- ↔ MnO42- E3o = +0,54V
يتضح من المعادلتين أعلاه أن:
E MnO4-/MnO2 يتعلق كثيراً بـِ [-OH]
في حين أن
-E MnO4-/MnO42 لا يتعلق بوسط المحلول.
ولما كانت قيمة الكمون القياسي +EoMnO4-/Mn2 أكبر
من كلا القيمتين Eo MnO4-/MnO2 و -Eo MnO4-/MnO42
لذا تُجرى غالباً معايرة جميع المواد القادرة على التأكسد بالبرمنغنات في وسط حمضي.
إضافة تعليق
التعديل الأخير تم: 15/07/2021