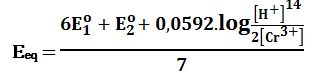كمون نقطة التكافؤ لتفاعل أكسدة وإرجاع له علاقة بدرجة حموضة المحلولequivalence potential point of a related redox reaction to PH of the solution
كمون نقطة التكافؤ لتفاعل أكسدة وإرجاع له علاقة بدرجة حموضة المحلول
في الحالة التي يتعلق فيها تفاعل الأكسدة والإرجاع بدرجة حموضة المحلول يُمكن الحصول على علاقة لكمون التكافؤ مختلفة عن تلك التي تم إيجادها في الحالة التي لا يتعلق فيها تفاعل الأكسدة والإرجاع بدرجة حموضة المحلول.
مثال على ذلك أكسدة الحديدي بشاردة البرمنغنات في وسط حمضي حيث يحصل التفاعل:
MnO4- + 5Fe2+ + 8H+ ↔ Mn2+ + 5Fe3+ +4H2O
وهو محصلة التفاعلين النصفيين التاليين:
MnO4- +8H+ +5e- ↔ Mn2++4H2O Eo1
5Fe2+ ↔ 5Fe3+ +5e- Eo2
عند نقطة التكافؤ يكون كمون المحلول Eeq بحيث : Eeq=E1=E2
يُلاحظ هنا أن كمون نقطة التكافؤ Eeq يتعلق بـِ PH المحلول.
وبالمثل يُمكن إيجاد كمون نقطة التكافؤ للتفاعل:
Cr2O72- +6Fe2+ + 14H+ ↔ 2Cr3+ +6Fe3+ +7H2O
على النحو التالي:
حيث Eo1 الكمون القياسي للزوج +Cr2O72-/Cr3
و Eo2 الكمون القياسي للزوج +Fe3+/Fe2 .
Cr2O72-]/1=[Fe2+]/6] و Cr3+]/2=[Fe3+]/6] .
إضافة تعليق
التعديل الأخير تم: 15/07/2021