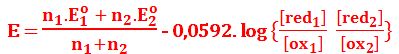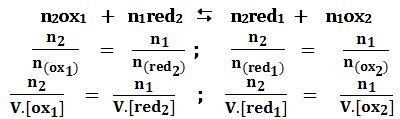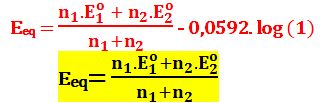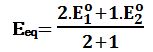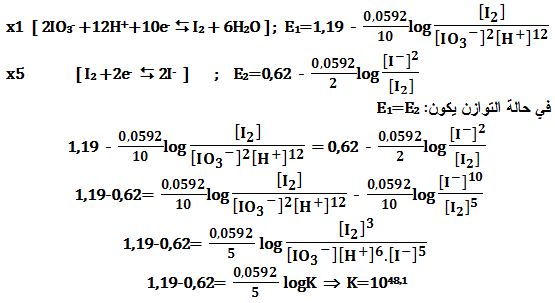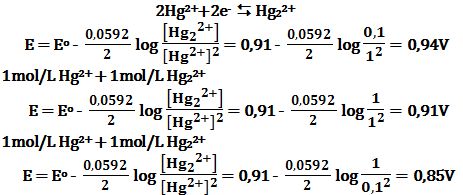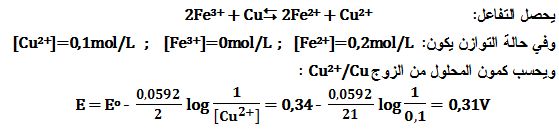كمون نقطة التكافؤ لتفاعل أكسدة وإرجاع لا علاقة له بدرجة حموضة المحلول equivalence potential point of an unrelated redox reaction to pH of the solution
كمون نقطة التكافؤ لتفاعل أكسدة وإرجاع لا علاقة له بدرجة حموضة المحلول
يُمكن التعبير عن التفاعلات النصفية للمؤكسد والمرجع بافتراض أنها لا تتعلق بدرجة حموضة المحلول بالشكل :
تفاعل إرجاع المؤكسد ox1 :
ox1+n1e-↔red1 x n2
تفاعل أكسدة المرجع red2 :
red2 ↔ ox2+n2e- x n1
تفاعل الأكسدة والإرجاع:
n2ox1+n1red2 ↔n2red1+n1ox2
تصل الجملة إلى حالة التوازن عندما يكون كمون المحلول E عند هو ذاته بالنسبة لزوجي الأكسدة والإرجاع في الجملة، أي:
E1(ox1/red1)=E2(ox2/red2)=E
فإذا كان Eo1 و Eo2 الكمون القياسي لكل من زوجي الأكسدة والإرجاع المتفاعلين فإن:
أي أن كمون المحلول في حالة التوازن E هي:
ويُمكن إيجاد كمون المحلول عند نقطة التكافؤ Eeq حيث يتساوى عدد المكافئات الغرامية للمؤكسد المتفاعل مع عدد المكافئات الغرامية للمرجع المتفاعل.
عند تقطة التكافؤ يكون:
حيث: (n(ox1) ، n(red2)، n(ox2) و (n(red1 هي
أعداد مولات ox1 ، red2 ، ox2 و red1 على الترتيب المتفاعلة والناتجة عن التفاعل عند نقطة التكافؤ،
و V حجم المحلول عند نقطة التكافؤ.
ومنه: [ox1][ox2]=[red1][red2]
وبالتعويض في علاقة كمون المحلول في حالة التوازن E فإن كمون الجملة عند نقطة التكافؤ Eeq
تطبيق:
ليكن التفاعل: +Sn2+ + 2Fe3+ ↔ Sn4+ +2 Fe2
الذي هو محصلة التفاعلين النصفيين التاليين:
(+Sn2+ ↔Sn4+ +2e- Eo1(Sn4+/Sn2
(+2Fe3++2e- ↔2Fe2+ Eo2(Fe3+/Fe2
عند نقطة التكافؤ يكون:
Fe3+]/2=[Sn2+]/1 ; [Sn4+]/1=[Fe2+]/2]
ويكون كمون الجملة عند نقطة التكافؤ:
يلاحظ أن كمون نقطة التكافؤ Eeq لا تتعلق بـِ PH المحلول.
تمرين ـ يُمزج 0,1mol/L من -IO3 مع 0,1mol/L من -I ويُضاف إليها 0,001mol/L من حمض قوي.
احسب PH المحلول كذلك كمون الأكسدة وارجاع.
المعطيات:
( Eo(I2/I-)=0,62V ; Eo(IO3-/I2)=1,19 (at PH=0
تمرين ـ احسب قيم كمونات الأكسدة والإرجاع للمحاليل التي يتم الحصول عليها من المزائج التالية:
(a)
+1mol/L Hg2+ + 0,1mol/L Hg22
+1mol/L Hg2+ + 1mol/L Hg22
+1mol/L Hg2+ + 0,1mol/L Hg22
(b)
+1mol/L Cr2+ + 0,2mol/L Fe3
+0,2mol/L Cr2+ + 1mol/L Fe3
+1mol/L Cr2+ + 1mol/L Fe3
(c)
0,2mol/L Fe3+ +Cuزيادة
المعطيات:
Eo(Hg2+/Hg22+)=0,91V ; Eo(Cu2+/Cu)=0,34V
Eo(Cr3+/Cr2+)=-0,41V ; Eo(Fe3+/Fe2+)=0,78V
(a)
+1mol/L Hg2+ + 0,1mol/L Hg22
مزيج من مؤكسد ومرجع للجملة ذاتها
(b)
+1mol/L Cr2+ + 0,2mol/L Fe3
(c)
0,2mol/L Fe3+ +Cu زيادة
تمرين ـ يُمكن معايرة شاردة الحديدي +Fe2 بمؤكسد ox مناسب.
أوجد الشرط الذي يحققه الكمون القياسي للزوج -ox/red: red ↔ ox+ne
للقيام بهذه المعايرة إذا افترض أن الخطأ الأعظمي [+Fe2+]/[Fe3] لا يتجاوز 3-10.
المعطيات:
Eo(Fe3+/Fe2+)=0,77V
إضافة تعليق
التعديل الأخير تم: 15/07/2021