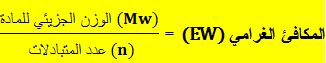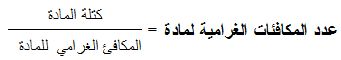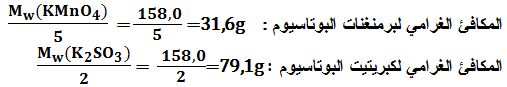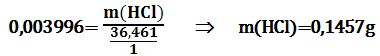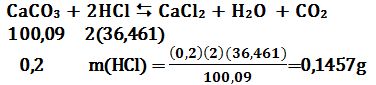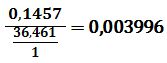تعريف المعايرة الحجمية وقانونها Volumetric titration definition and law
تعريف المعايرة الحجمية وقانونها
المعايرة الحجمية هي عملية تحديد تركيز مادة عن طريق قياس حجم محلول عياري يُستخدم لإجراء التفاعل الكيميائي اللازم مع هذه المادة والوصول إلى نهاية التفاعل.
تُسمى هذه النقطة التي حدث فيها انتهاء التفاعل بنقطة التكافؤ.
تُقسم هذه التفاعلات إلى أربعة أنواع وهي
(1) تفاعلات التعديل حمض ـ أساس ؛
(2) تفاعلات المعايرة بالترسيب ؛
(3) تفاعل المعايرة بتشكيل المعقدات
و(4)تفاعلات المعايرة بالأكسدة والإرجاع.
يُعبَّر عن النسب الكمية بين كتل المواد المتفاعلة بقانون المكافئات
الذي ينص على أن العناصر الكيميائية أو مركباتها تتفاعل مع بعضها بعض بكميات وزنية محددة تماماً وتوافق مكافئاتها الكيميائية.
ففي أي تفاعل كيميائي يتفاعل مكافئ غرامي واحد من مادة ما مع مكافئ غرامي واحد فقط من مادة أُخرى.
يُعرف المكافئ الغرامي لمادة تدخل في تفاعل كما يلي:
في تفاعلات حمض ـ أساس : المكافئ الغرامي لمادة هو كتلة المادة بالغرام اللازمة للتفاعل مع شاردة غرامية واحدة من +H أي 1,008g .
في تفاعلات الترسيب أو تشكيل المعقدات : المكافئ الغرامي لمادة هو كتلة المادة بالغرام اللازمة للتفاعل مع شاردة أحادية واحدة ،نصف شاردة ثنائية ، ثلث شاردة ثلاثية وهكذا.
في تفاعلات الأكسدة والإرجاع : المكافئ الغرامي لمادة هو كتلة المادة بالغرام اللازمة للتفاعل مع شاردة غرامية واحدة من الالكترونات.
ويُمكن التعبير بشكل عام عن المكافئ الغرامي لمادة بالعلاقة التالية:
إن عدد المتبادلات n تساوي إلى:
عدد البروتونات ( شوارد +H ) في تفاعلات حمض ـ أساس.
عدد الشوارد الأحادية التي تتحد مع المادة في تفاعلات الترسيب أو تشكيل المعقدات.
عدد الشوارد الغرامية من الالكترونات المتبادلة في تفاعلات الأكسدة والإرجاع.
وتُعرف نقطة التكافؤ بأنها النقطة التي توافق النسبة التكافؤية بين المادة المدروسة والمادة المتفاعلة معها ،
أي عندما يكون عدد المكافئات الغرامية للمادة المدروسة (1) مساوياً إلى عدد المكافئات الغرامية للمادة المتفاعلة معها (2).
أي: N1.V1=N2.V2
حيث N هي التركيز بالنظامية ( عدد المكافئات الغرامية في الليتر) و V الحجم بالليتر.
إن عدد المكافئات الغرامية لمادة ما ليست إلاّ حاصل قسمة كتلة المادة على مكافئها الغرامي.
+λ2x acid(1) + λ1 H2O ↔ base(1) + λ1 H3O
λ1x base(2) + λ2H3O+↔ acid(2) + λ2 H2O
(λ2 acid(1) + λ1 base(2) ↔ λ2 base(1) + λ1 acid(2
عند نقطة التكافؤ يكون:
عدد البروتونات التي أخذها مول واحد من الأساس(2) = عدد البروتونات التي خسرها مول واحد من الحمض(1)
(λ1.n(acid1) = λ2.n(base2
λ1. C1V1 = λ2. C2V2
حيث:
تركيز الحمض1 و حجمه V1 و C1
تركيز الأساس2 و حجمه V2 و C2
تمرين ـ احسب قيمة المكافئ الغرامي لكل من برمنغنات البوتاسيوم وكبريتيت البوتاسيوم في التفاعل:
5K2SO3 + 2KMnO4 +3H2SO4↔5K2SO4 +2MnSO4 +K2SO4 + 3H2O
تُكتب المعادلتين الشارديتين الممثلتين لنصفي التفاعل:
MnO4- + 8H+ + 5e- ↔ Mn2+ +4H2O
-SO32- + H2O ↔ SO42- + 2H+ +2e
تمرين ـ احسب قيمة المكافئ الغرامي لفوسفات المغنزيوم في التفاعل:
Mg3(PO4)2 + 6HCl ↔ 3MgCl2 + 2H3PO4
المكافئ الغرامي لفوسفات المغنزيوم يُساوي:
حيث يتم استبدال 6 شوارد +H حسب التفاعل الكيميائي.
تمرين ـ احسب عدد المكافئات الغرامية وكذلك كتلة HCl اللازمة لإنحلال 0,20g من CaCO3
تُكتب معادلة التفاعل:CaCO3 + 2HCl ↔ CaCl2 + H2O + CO2
إن عدد المكافئات الغرامية لكربونات الكالسيوم = عدد المكافئات الغرامية لحمض كلور الماء.
وهو ذات العدد اللازم من حمض كلور الماء للتفاعل. يُمكن حساب كتلة HCl من معرفة عدد مكافئاتها الغرامية، أي:
يُمكن بشكل آخر بدء حساب كتلة HCl اللازمة كما يلي:
CaCO3 + 2HCl ↔ CaCl2 + H2O + CO2
ويكون عدد المكافئات الغرامية من HCl يُساوي:
إضافة تعليق
التعديل الأخير تم: 12/07/2021