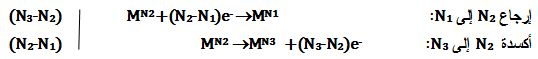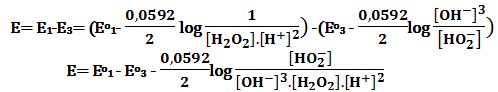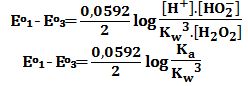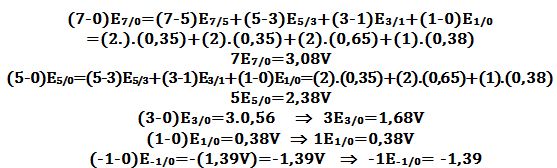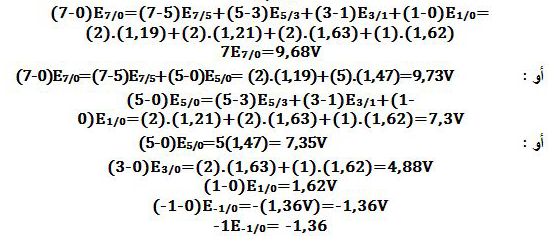تفاعلات الأكسدة والإرجاع الذاتية self redox reactions
تفاعلات الأكسدة والإرجاع الذاتية
يُمكن التنبؤ بعملية أكسدة وإرجاع ذاتية بطرق متعددة يُمكن تلخيصها بالأمثلة التالية:
1ـ E(reaction)>0 :
من المعلوم أن للنحاس ثلاثة درجات أكسدة Cu و +Cu و +Cu2 .
يُمكن استنتاج أن شوارد النحاسي +Cu غير ثابتة في المحليل المائية
وذلك بمقارنة الكمونات القياسية للزوجين (Cu+/Cu(s و (Cu2+/Cu(s والتي هي 0,52V و 0,34V على التوالي:
أي أن شاردة النحاسي +Cu غير ثابتة في المحليل المائية
وتعاني من تفاعل أكسدة وإرجاع ذاتي (dismutation)
حيث تتحول شاردة النحاسي +Cu إلى شاردة النحاس +Cu2 (درجة أكسدة أعلى من +Cu ) و عنصر النحاس Cu ( درجة أكسدة أخفض من +Cu ).
2ـ من مخطط الرجحان:
عندما يكون لعنصر أكثر من درجة أكسدة ،
فإن عدد من مركباته يُمكن أن يُعاني من تفاعل أكسدة وإرجاع ذاتي (Dismutation)،
وذلك عندما يسلك المركب سلوك مؤكسد في زوج أكسدة وإرجاع
وسلوك مرجع في زوج آخر كمونه القياسي أخفض من الكمون القياسي للزوج الأول.
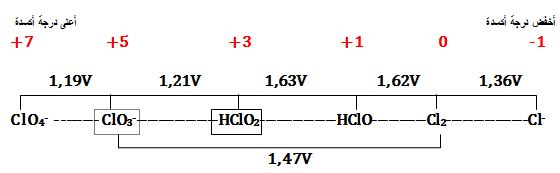
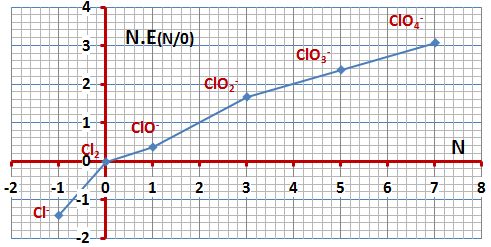
مثال: يُبين المخطط التالي مخطط الرجحان للأنواع الكيميائية
الخاصة بعنصر الكلور في الوسط الحمضي:
إن كلاً من HClO2 و -ClO3 يُمكن أن يُعاني من تفاعل أكسدة وإرجاع ذاتي في محاليله المائية الحمضية،
بينما يكون كل من -ClO4 و -Cl مستقراً ترموديناميكياً في تلك المحاليل.
7ClO3- +2H+ ↔ 5ClO4- + Cl2 + H2O
2ClO3- + H+ ↔ ClO4- + HClO2
+2HClO2 ↔ ClO3- + HClO + H
3ـ من مخطط Latimer
الذي يُبين قيم كمونات الإرجاع القياسية لمختلف درجات الأكسدة لعنصر ما في الأوساط المائية،
بحيث تقع أعلى درجة أكسدة على اليسار وأدنى درجة أكسدة على اليمين.
يُمكن التنبؤ بعمليات الأكسدة والإرجاع الذاتي (dismutation) التي يُمكن أن تحصل وذلك كما يلي:
عندما تكون قيمة كمون الإرجاع القياسي الذي على يسار المركب أصغر ( جبرياً)
من تلك القيمة التي على يمينه،
ذلك مؤشر أن ذلك المركب يُمكن أن يُؤكسِد ويُرجِع نفسه.
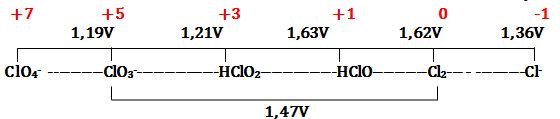
مثال: ليكن مخطط Latimer للكلور في الوسط الحمضي
إن كلاً من -ClO3 و HClO2 يُمكن أن يُعاني من تفاعل أكسدة وإرجاع ذاتي في محاليله المائية الحمضية.
4ـ من مخطط فروست:
استطاع فروست Frost Arthur عام 1950 إيجاد مخطط
يسمح بالتنبؤ بتحديد ثباتية درجة أكسدة لعنصر له عدة درجات أكسدة في مركباته
والتنبؤ بتفاعلات الأكسدة والإرجاع الذاتية ،
وذلك بالإعتماد على مفهوم أن التفاعل يكون تلقائياً عندما يكون تغير الطاقة الحرة له سالباً (ΔG=-nFE<0).
لتكن العناصر الكيميائية MN1 و MN2 و MN3 الموافقة
لثلاثة درجات أكسدة N1 و N2 و N3 للعنصر M
حيث تقع N2 بين N1 و N3 أي :
N3>N2>N1.
يُمكن كتابة التفاعلات النصفية التالية:
التي تؤدي إلى التفاعل التالي حيث يتحول العنصر MN2 إلى العنصرين MN1 و MN3
وذلك بعد ضرب التفاعل الأول بالعدد (N3-N2) والتفاعل الثاني بالعدد (N2-N1) وجمعهما :
N1-N3)MN2 →(N2-N3)MN1 +(N1-N2)MN3)
ولكي يكون هذا التحول تلقائياً فإنه يجب أن يكون تغير الطاقة الحرة له سالباً: ΔG <0 .
يُمكن حساب ΔG حسب مبادئ الترموديناميك
من الفرق بين مجموع الطاقات الحرة القياسية للتشكل لنواتج التفاعل و مجموع الطاقات الحرة القياسية للتشكل للمواد المتفاعلة، أي:
ΔG =[(N1-N2)( ΔGfoN3)+(N2-N3)( ΔGfoN1)]-[(N1-N3)( ΔGfoN2)]<0
حيث ΔGfoN1و ΔGfoN2 و ΔGfoN3 هي الطاقة الحرة القياسية لتشكل كل من العناصر MN1 و MN2 و MN3 على التوالي ،
وذلك انطلاقاً من العنصر الافتراضي Mo الذي تُعتبر درجة أكسدته مساوية إلى الصفر:
M0 → MN1 + N1e- ΔGfoN1
M0 → MN2 +N2e- ΔGfoN2
M0 → MN3 +N3e- ΔGfoN3
يُلاحظ أن هذه التفاعلات هي التفاعلات العكسية لإرجاع كل من MN1 و MN2 و MN3 إلى M0:
(MN1 +N1e-→M0 ΔGo1 =-N1FEo(MN1/Mo
(MN2 +N2e-→M0 ΔGo2 =-N2FEo(MN2/Mo
(MN3 +N3e-→M0 ΔGo3 =-N3FEo(MN3/Mo
وبالتالي يُمكن الربط بين الطاقة الحرة القياسية للتشكل وكمون الإرجاع:
ΔGo1 =- ΔGfoN1 و ΔGo2 =- ΔGfoN2 و ΔGo3 =- ΔGfoN3
ومنه يُصبح شرط التفاعل التلقائي:
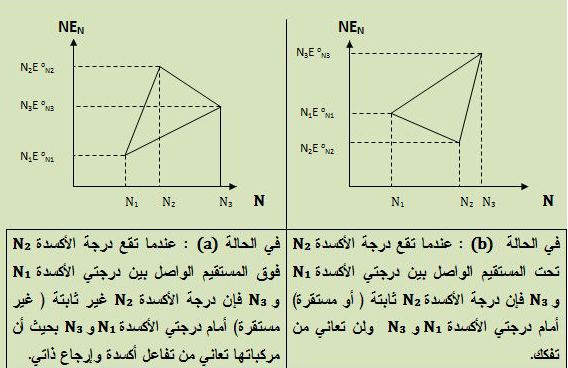
يُمكن مناقشة ماذا تعني هذه المتراجحة من خلال الدراسة التحليلية التالية:
إن معادلة المستقيم المار من النقطتين (N1, N1EoN1) و (N3, N3EoN3)
في جملة الاحداثيات (N, NEoN) هي :
يُمكن بإعادة ترتيب هذه المعادلة واختصار الحدود المتشابهة إيجاد المعادلة التالية:
في الحالة التي تكون فيها النقطة (N2, N2EoN2) تقع على هذا المستقيم
فهي تحقق معادلته ويكون الإحداثي الشاقولي لهذه النقطة يُساوي:
أما إذا كانت النقطة (N2, N2EoN2) تقع فوق المستقيم فإن إحداثيها الشاقولي يجب أن يحقق المتراجحة:
وهي المتراجحة ذاتها المطلوب دراستها .
يُمكن تلخيص ما توصل إليه فروست كما يلي: لتكن النقاط الثلاثة
(N1, N1EoN1) و (N2, N2EoN2) و (N3, N3EoN3) في المستوي (N, NEN) ،
حيث تعبِّر N عن مختلف درجات الأكسدة للعنصر M بحيث (N3>N2>N1)
و EN هو كمون زوج الأكسدة والإرجاع (MN/M0) ،
وتشير القيمة 0 إلى درجة الأكسدة صفر للعنصر M.
يُمكن تموضع النقاط بالنسبة لبعضها البعض كما في الشكلين التاليين (a) و (b):
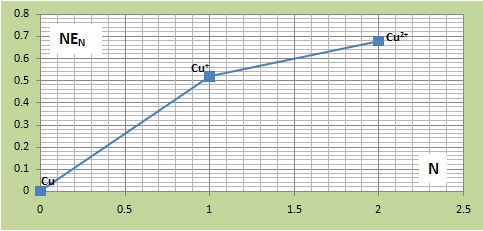
يُمكن تطبيق مخطط فروست على النحاس وملاحظة أن Cu+ غير مستقرة وتتحول إلى Cu و +Cu2.
حيث:
Eo(Cu/Cu)=0 , Eo(Cu+/Cu)=0,52V , Eo(Cu2+/Cu)=0,34V
(N.Eo(Cu/Cu)=0 , N.Eo(Cu+/Cu)=1.(0,52) , N.Eo(Cu2+/Cu)=2.(0,34
ملاحظة:
هناك عوامل تحريكية Kinetic يُمكن أن تتدخل في عملية أكسدة وإرجاع ذاتي Dismutation،
فالإمكانية الترموديناميكية لحدوث عملية لا تعني بالضرورة حدوثها عملياً
خاصة عندما تكون النقطة N2 قريبة جداً من المستقيم N1N3 .
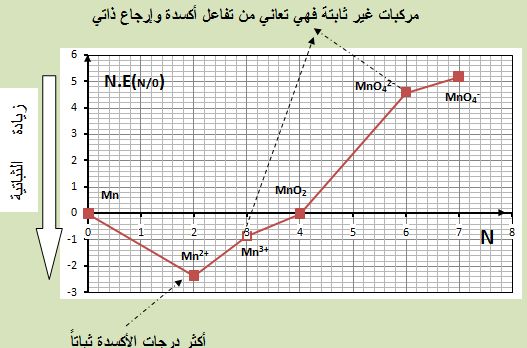
تمرين ـ للمنغنيز Mn ستة درجات أكسدة هي: 7+ ,6+ ,4+ ,3+ ,2+ , 0 .
تُعطى الكمونات القياسية لأزواج الأكسدة والإرجاع (من أجل PH=0) التالية:
Mn2+/Mn Eo(MnII/Mn0)=-1,18V
Mn3+/Mn2+ Eo(MnIII/MnII)=+1,51V
MnO2/Mn2+ Eo(MnIV/MnII)=+1,23V
MnO42-/Mn2+ Eo(MnVI/MnII)=+1,74V
MnO4-/Mn2+ Eo(MnVII/MnII)=+1,51V
ارسم مخطط فروست للمنغنيز من أجل PH=0 وتراكيز مولية للمنغنيز(1mol/L) واستنتج أن:
أـ الشاردة -MnO42 غير مستقرة و تتفكك إلى -MnO4 و MnO2
ب ـالشاردة +Mn3 هي غير مستقرة أيضاً و تتفكك إلى +Mn2 و (MnO2(s .
بالإعتماد على علاقة Luther يُمكن حساب الكمونات القياسية للأزواج
(Eo(MnII/Mn0) و (Eo(MnIII/Mn0 و (Eo(MnIV/Mn0 و (Eo(MnVI/Mn0 و (Eo(MnVII/Mn0 كما يلي:
(3-0). Eo(MnIII/Mn0) = (3-2). Eo(MnIII/MnII) + (2-0). Eo(MnII/Mn0) =-0.85V
(4-0). Eo(MnIV/Mn0)= (4-2). Eo(MnIV/MnII) + (2-0). Eo(MnII/Mn0) =0.10V
(6-0). Eo(MnVI/Mn0) =(4-2). Eo(MnVI/MnII) + (2-0). Eo(MnII/Mn0) =4,60V
ويضاف إليها :
يُبين الشكل التالي مخطط فروست للمنغنيز من أجل PH=0 وتراكيز مولية للمنغنيز(1mol/L) .
يُستنتج أن شوارد المنغنات -MnO42 ( حيث درجة أكسدة المنغنيز +6) تتفكك إلى
MnO2 (حيث درجة أكسدة المنغنيز +4) و -MnO4 (حيث درجة أكسدة المنغنيز +7):
MnO42- +4H+ +2e-↔MnO2+2H2O E1o=1,69V
2MnO42-↔2MnO4- + 2e- E2o=-0,60V
3MnO42-+4H+↔MnO2+2MnO4-+2H2O
Eo=E1o+E2o=+1,69+(-0,60)=1,09V>0
أو:
( ΔGo=ΔG1o+ΔG2o=-2FE1o+(+2FE2o
ΔGo/F =-2E1o+(+2E2o)=2(-0,60-1,69)<0
كذلك أن +Mn3 هي غير مستقرة أيضاً و تتفكك إلى +Mn2 و (MnO2(s :
+2Mn3++2H2O→Mn2++MnO2(s)+4H
ملاحظة:
إذا لم التراكيز مولية (1mol/L) يُمكن تطبيق علاقة نرنست لحساب كمونات الأزواج السابقة من أجل قيم تلك التراكيز.
تمرين ـ يُعطى الجدول التالي:
|
الكمون القياسي 25oC |
التفاعل النصفي |
زوج الأكسدة والإرجاع |
الرقم |
|
Eo1=1,78V |
H2O2+H++e- ↔ H2O |
H2O2/H2O |
1 |
|
Eo2=0,68V |
O2+H++e- ↔ H2O2 |
O2/H2O2 |
2 |
|
Eo3=0,88V |
-HO2- +H2O+e- ↔ OH |
HO2-/OH- |
3 |
والمطلوب:
أولاً:
1- وازن أنصاف تفاعلات الأكسدة والإرجاع الثلاثة في الجدول.
2- رتب الأزواج 1 و 2 و 3 حسب تناقص قوة المؤكسد.
3- يتم عمل خلية بمساعدة الزوجين 1 و 3 . اكتب التفاعل الكيميائي المحصل عندما تعمل الخلية.
4- بمقارنة الزوجين1 و 2 ، برهن أن الماء الأكسجيني(المحلول المائي لـِ H2O2 ) يتفكك تلقائياً.
ثانياً: بمساعدة الخلية السابقة (في أولاً -3) يُمكن دراسة الخصائص الحمضية للماء الأكسجيني، الذي هو حمض ضعيف وحيد الوظيفة.
اكتب تفاعل تفكك (حمض-أساس) للماء الأكسجيني في الماء وعبارة ثابت الحموضة Ka ،
ثم اكتب عبارة القوة المحركة الكهربائية للخلية E (في أولاً-3).
ما هي قيمة E عندما تصل الخلية إلى حالة التوازن؟
ثم برهن أنه من الممكن كتابة ثابت الحموضة Ka بدلالة ثابت الجداء الشاردي للماء Kw .
أولاً:1ـ
|
H2O2+2H++2e- ↔ 2H2O |
|
O2+2H++2e- ↔ H2O2 |
|
-HO2- +H2O+2e- ↔ 3OH |
2ـ ترتيب المؤكسدات (2) < (3) < (1)
3ـ الزوج الذي كمونه القياسي هو الأعلى هو الذي يُعاني من عملية إرجاع (الزوج 1) ،
ويتفاعل مؤكسده (H2O2) مع مرجع الزوج ذي الكمون الأخفض(-OH):
H2O2+2H++2e- ↔ 2H2O E1o
3OH-↔HO2- +H2O+2e- -E3o
H2O2+2H++3OH- ↔ 3H2O+HO2-
لكن:
H++OH-↔H2O
-H2O2+OH- ↔ H2O+HO2
4-
H2O2+2H++2e- ↔ 2H2O
-H2O2↔O2+2H++2e
2H2O2 ↔ 2H2O+O2
ثانياً:
-H2O2+H2O ↔ H3O++HO2
بتطبيق علاقة نرنست:
ومنه:
في حالة التوازن يكون E=0 ومنه:
وهي العلاقة التي تربط ثابت الحموضة Ka بالجداء الشاردي للماء والكمونات القياسية Eo1 و Eo3 .
تمرين ـ ارسم مخطط فروست للكلور في الوسط الأساسي واستنتج أن التحولات الآتية ممكنة:
غاز الكلور Cl2 إلى -Cl و -ClO ؛
-ClO2 إلى -ClO3 و -ClO ؛
-ClO إلى -ClO3 و -Cl ؛
-ClO3 إلى -ClO4 و -Cl
وأخيراً -ClO إلى -ClO2 و -Cl .
اعتمد على مخطط Latimer الذي يبين قيم كمونات الإرجاع القياسية لمختلف درجات الأكسدة للكلور في الوسط الأساسي:
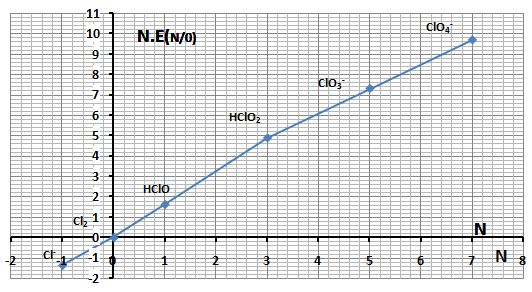
تمرين ـ أوجد مخطط فروست للكلور في الوسط الحمضي بالإعتماد على مخطط Latimer التالي:
ويكون مخطط فروست كالتالي:
ملاحظة: لا يُمكن لـِ Cl2 أن يتحول إلى -Cl و -ClO3 في الوسط الحمضي لأن:
Cl2+6H2O↔2ClO3-+12H++10e- Eo1=-1,47V
5Cl2+10e-↔10Cl- Eo2=+1,36V
6Cl2+6H2O↔2ClO3-+10Cl-+6H+ Eo=-1,47+1,36= -0,11V <0
بينما يُمكن لذلك التحول أن يحصل في الوسط الأساسي (التمرين السابق).
إضافة تعليق
التعديل الأخير تم: 12/07/2021