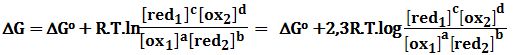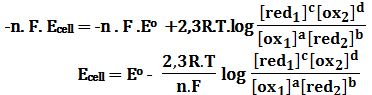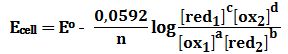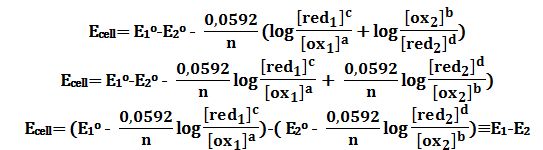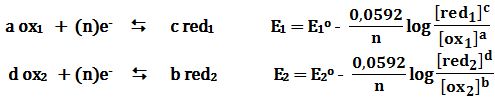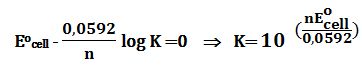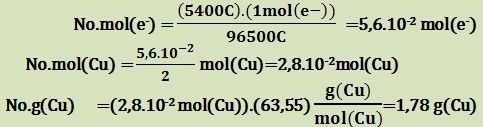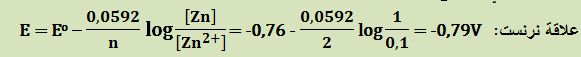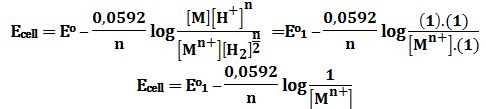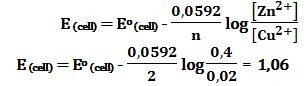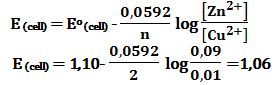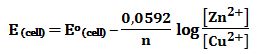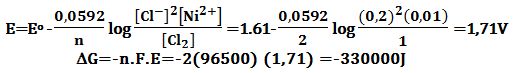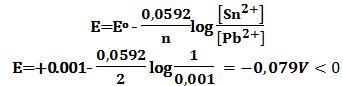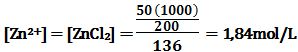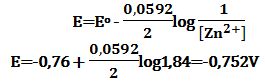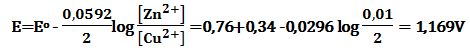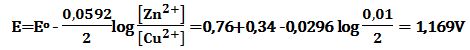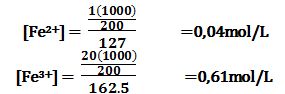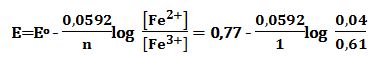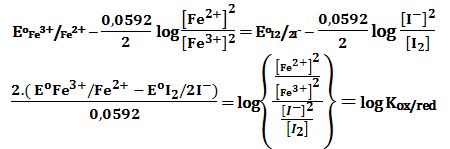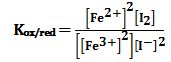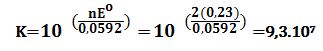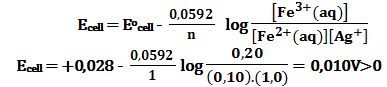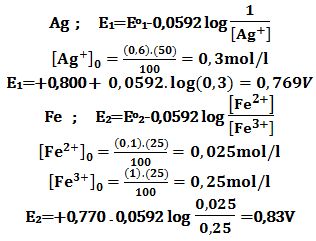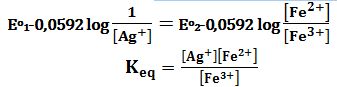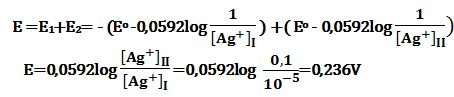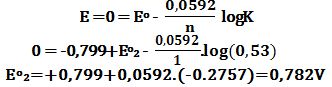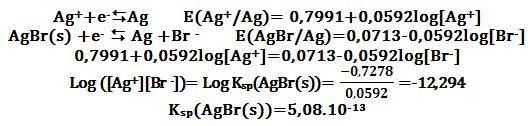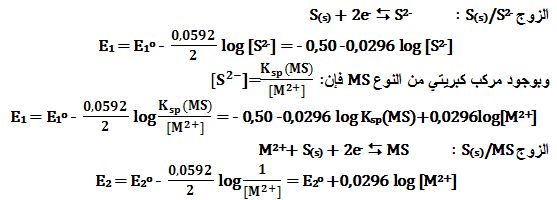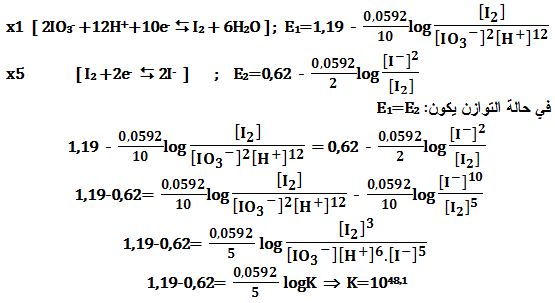علاقة نرنست Nernst equation
علاقة نرنست
إذا لم يكن تركيز الشوارد أو ضغوط الغازات في الخلية الغلفانية قياسية،
أي أن تركيز الشوارد لا يُساوي 1mol/L
أو ضغط الغاز لا يُساوي 1atm
فإن الكمون المسروي للخلية لا يُساوي (Eo(cell.
استطاع العالم نرنست إيجاد علاقة تابعية الكمون المسروي بدلالة تركيز المحلول،
وذلك من تعريف العمل الأعظمي المرافق لتحول الطاقة الكيميائية إلى طاقة كهربائية دون ضياع حراري
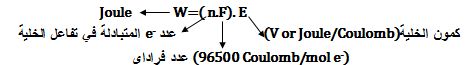
إن العمل الكهربائي W هو جداء كمية الكهرباء المارة في الدارة (n.F) بفرق الكمون (E) الذي يسبب مرور التيار ( أو كمون الخلية) وتُعطى صيغته بالعلاقة:
إذ أنه لدى عبور شحنة كهربائية بمقدار كولون واحد من خلال فرق كمون قدره فولط واحد يتولد عملاً قيمته جول واحد؛(1J=1V.1C) .
ويُبرهن في علم الترموديناميك أن تغير الطاقة الحرة (تابع جيبس) لتفاعل الخلية يُساوي إلى العمل الكهربائي الذي تقوم به الخلية ولكن بإشارة معاكسة.
لكي تعمل الخلية بشكل تلقائي فإن : ΔG = - n. F. E <0 أي: E >0
والشكل التالي يُبيِّن تمثيلاً ميكانيكياً لمفهوم العمل الموجب والسالب.
لو افترض أن تفاعلات نصفي الخلية: (إرجاع) red2|ox2|| ox1|red1 (أكسدة)
هي:
إرجاع: (a ox1 + ne- ↔ c red1 E1o ( ox1 / red1
أكسدة: (b red2 ↔ d ox2 + ne- -E2o ( ox2 / red2
فإن التفاعل الكيميائي المحصل ضمن الخلية هو من الشكل:
a ox1 + b red2 ↔ c red1 + d ox2 Eocell=E1o-E2o
ويُبرهن في علم الترموديناميك أن تغير الطاقة الحرة للتفاعل تُعطى بعلاقة تابعة للتراكيز كما يلي:
حيث ΔGo تغير الطاقة الحرة للتفاعل في الحالة القياسية أي عندما تكون التراكيز 1mol/L.
ومنه يُمكن إيجاد:
بما أن:
R=8.3 J/(mol.K) ; F=96500 coul/mol
يكون كمون الخلية (E) مرتبطاً بكمون الخلية العياري Eo في الدرجة 250C حيث (T=25+273=298K) بالعلاقة :
تُدعى هذه العلاقة بعلاقة نرنست.
لدى تطبيق علاقة نرنست يُمكن القبول أن:
H2O]=1mol/L]
solid]=1mol/L]
(gas]=Pgas(atm]
يُمكن إعادة كتابة علاقة نرنست بالشكل:
حيث E1 و E2 هما كمونا الإرجاع للزوجين ox1/red1 و ox2/red2 :
لكي تعمل الخلية كخلية غلفانية يجب أن يكون كمونها موجباً ،
أي يجب أن يكون الفرق بين كموني إرجاع زوجي الأكسدة والإرجاع للخلية موجباً :
Ecell = E1-E2 >0
يُستنتج من ذلك أنه لتشكيل خلية غلفانية من زوجي أكسدة وإرجاع ،
فإن الزوج ذو كمون الإرجاع الأعلى يشكل المسرى الذي يحصل عليه عملية الإرجاع (مسرى الطرف الأيمن) ،
ويُشكل بالتالي الزوج ذو كمون الإرجاع الأخفض المسرى الذي يحصل عليه عملية الأكسدة (مسرى الطرف الأيسر).
وتكون القوة المحركة الكهربائية لتلك الخلية Ecell مساوية إلى الفرق بين كمون إرجاع مسرى الطرف الأيمن E1 وكمون إرجاع مسرى الطرف الأيسر E2 ،
أي المجموع الجبري لكمون إرجاع مسرى الطرف الأيمن E1 وكمون أكسدة مسرى الطرف الأيمن E2- .
يُلاحظ أن كمون الخلية Ecell = E1-E2 >0 مستقل عن الكمون الاختياري الذي اعتبر مبدأ للكمون.
عندما يصبح كمونا المسريين متساويين E1=E2، فإن الجملة تصل إلى حالة التوازن الكيميائي ، وبالتالي يُصبح كمون الخلية E معدوماً (Ecell,eq=0).
عند عمل الخلايا الغلفانية تبقى الالكترونات متدفقة عبر السلك المعدني الذي يصل بين المسريين، ويدل على ذلك فرق الكمون المتولد بين المسريين. وخلال ذلك يتناقص تركيز المواد المتفاعلة ويزداد تركيز المواد الناتجة عن تفاعل الخلية، وتتناقص قيمة فرق الكمون المتولد حتى يُصبح مساوياً إلى الصفر. وعند هذه النقطة يتوقف تدفق الالكترونات وبالتالي يتوقف عمل الخلية ويُقال أن الخلية وصلت إلى حالة توازن ديناميكي وتبقى فيها التراكيز ثابتة.
وفي حالة التوازن الكيميائي يُمكن كتابة العلاقة:
حيث : Eocell=E1o - E2o الكمون القياسي للخلية.
إن قيم كمونات الإرجاع القياسية للتفاعلات النصفية التي تجري على المساري E1o و E2o تؤخذ مباشرة من الجداول الخاصة لذلك
ويجب أن لا تُضرب قيمها بالعامل الذي يُستعمل لتوحيد عدد الالكترونات في التفاعلات النصفية للخلية للحصول على التفاعل المحصل النهائي لها.
يُمكن إيجاد ثابت توازن تفاعل الأكسدة والإرجاع K من العلاقة:
ومن معرفة الكمون القياسي للخلية Eocell وعدد التبادل الالكتروني n للخلية ، يُمكن حساب ثابت التوازن K لتفاعل الخلية.
إذا اختلفت درجة الحرارة عن 25oC ، يُمكن البرهان أن الكمون القياسي Eot في درجة الحرارة t يرتبط مع الكمون القياسي Eo25 في الدرجة 25oC بالعلاقة:
يُسمى ![]() ُُُ بمعامل درجة الحرارة (Isothermal Temperature Coefficient) وله قيمة محددة من أجل كل زوج أكسدة وإرجاع .
ُُُ بمعامل درجة الحرارة (Isothermal Temperature Coefficient) وله قيمة محددة من أجل كل زوج أكسدة وإرجاع .
تمرين ـ أوجد مستعيناً بجدول كمونات المساري فيما لو كان التفاعل بالاتجاه المكتوب به هو تلقائي:
-3I2+ 2Cr3+ + 7H2O ↔ Cr2O72- + 14H+ + 6I
تُكتب التفاعلات النصفية الحادثة والموافقة لتفاعل الخلية الكلي:
2Cr3+ + 7H2O ↔ Cr2O72- + 14H+ + 6e- Eo = -(+1,33 V)=-1,33V (أكسدة)
3I2 + 6e- ↔ 6I- Eo = +0,54 V (إرجاع)
إذاً يكون كمون الخلية وفق التفاعل المكتوب :
Eo (cell) = -1,33+0,54 = -0,79 V
والإشارة السالبة تدل على أن التفاعل السابق لا يحصل تلقائياً بالاتجاه المكتوب،
بل إن التفاعل العكسي هو الذي يحصل عند عمل الخلية:
Cr2O72- + 14H+ + 6I- ↔ 3I2+ 2Cr3+ + 7H2O
والكمون المسروي للخلية في هذه الحالة هو: Eo (cell) = +0,79 V
تمرين ـ ليكن مسرى كلور الفضة -Ag|AgCl|Cl
الذي يتألف من سلك من الفضة مغطى بطبقة من كلور الفضة ومغمور في محلول مشبع بكلور البوتاسيوم
(بحيث يكون تركيز شوارد الكلور في المحلول ثابتاً) .
اكتب المعادلات التي تجري على المسرى وكذلك احسب كمون المسرى.
يُمكن كتابة التفاعل المحصل على المسرى -Ag|AgCl|Cl كما يلي:
-AgCl(s)+e-↔ Ag(s) + Cl
يُعطى كمون المسرى بعلاقة نرنست:
[-E= Eo(AgCl/Ag)-0,0592 log [Cl
وبما أن تركيز شوارد الكلور [-Cl] ثابتاً ، فإن كمون المسرى E يكون ثابتاً دوماً ، وهذا ما يسمح باستخدامه كمسرى عياري (ثانوي).
تمرين ـ لقياس كمون المسرى القياسي للنحاس تُشكل الخلية الغلفانية تبعاً للتمثيل التالي:
Pt|H2(1atm) |H+(1mol/L) ||Cu2+(1mol/L) |Cu
تؤكد التجربة أن النحاس يترسب على مسرى النحاس
وأن الهيدروجين يتأكسد على مسرى البلاتين.
اكتب تفاعلات الأكسدة والإرجاع الحاصلة على المسريين
ثم ما هي كتلة النحاس المترسبة بالغرامات نتيجة مرور تيار كهربائي 1,5A لمدة ساعة واحدة في محلول كبريتات النحاس CuSO4 .
المعطيات: شحنة الالكترون تساوي إلى 96500 كولون .
الأمبير A هو عدد الكولونات المارة في الدارة في الثانية.
الكتلة الذرية للنحاس 63,55g/mol
يحصل تفاعل الأكسدة على المسرى الهيدروجيني:
-H2+2H2O↔2H3O+ +2e
وتفاعل الإرجاع على مسرى النحاس:
(Cu(aq)2+ +2e- → Cu(s
أي أن كل الكترونين يُمكنها ترسيب جزيئة نحاس واحدة
أي: (-1mol (Cu) ≈ 2mol(e
إن عدد الشحنات الكهربائية المارة في الدارة خلال ساعة واحدة يُساوي إلى:
No.Coulomb = (3600sec).(1,5 Coulomb/sec )=5400 C
تمرين ـ ما هو الكمون المسروي لصفيحة توتياء مغموسة في محلول من شوارد التوتياء +Zn2 بتركيز 0,1mol/L ؟
التفاعل النصفي الموافق: Zn2+ + 2e- → Zn Eo = -0,76 V
احسب تركيز الشوارد المعدنية +Mn بالإعتماد على قياس القوة المحركة الكهربائية للخلية الغلفانية المؤلفة من:
مسرى معدني M مغمور في محلول كهرليتي يحتوي على الشوارد +Mn مجهولة التركيز
ومسرى هيدروجيني عياري:
Pt|H2(g,1atm) | H+(1mol/L) || Mn+ | M
لما كان اصطلاحاً كمون المسرى الهيدروجيني مساوياً للصفر
فإن القوة المحركة الكهربائية المقاسة تُمثل كمون المسرى المعدني بالنسبة إلى المسرى الهيدروجيني العياري.
إن التفاعلين النصفيين في الخلية هما :
Mn++ne-→M Eo1
n (0.5H2→H++e-) Eo2=0V
والتفاعل الكهركيميائي المحصل للخلية هو:
+Mn++ (n/2) H2↔M+nH
Eocell=Eo1+0=Eo1
يُعطى كمون الخلية حسب علاقة نرنست بالعلاقة:
ومن معرفة كمون الإرجاع العياري Eo1 (للتفاعل النصفي الموافق Mn++ne-→M)
وقياس القوة المحركة الكهربائية للخلية Ecell ،
يُمكن حساب تركيز الشوارد +Mn من العلاقة السابقة.
تمرين ـ احسب قيمة كمون الخلية التالية :
Zn|Zn2+ (0,4mol/L) ||Cu2+ (0,02mol/L) |Cu
Zn2+ + 2e- ↔ Zn Eo (Zn2+/Zn) = -0,76 V عملية إرجاع
Cu2+ + 2e- ↔ Cu Eo (Cu2+/Cu) = +0,34 V عملية إرجاع
يحصل في الخلية تفاعل أكسدة وآخر إرجاع بحيث يكون كمون الخلية موجباً. لذلك فإن تفاعلات الخلية هي:
Zn ↔ Zn2+ + 2e- -Eo (Zn2+/Zn) = +0,76 V عملية أكسدة (نصف خلية)
Cu2+ + 2e- ↔ Cu Eo (Cu2+/Cu) = +0,34 V عملية إرجاع (نصف خلية)
والتفاعل المحصل للخلية هو مجموع تفاعلي نصفي الخلية:
Zn + Cu2+ ↔ Zn2+ + Cu Eo (cell) = +0,76+0,34 = 1,10 V
وبتطبيق علاقة نرنست يُمكن إيجاد كمون الخلية وفق التراكيز المعطاة:
(Zn + Cu2+ (0.02mol/L) ↔ Zn2+ (0.4mol/L) + Cu E (cell
تمرين ـ أ ـ لتكن الخلية Zn|Zn2+ (0,1mol/L) ||Cu2+ (0,1mol/L) |Cu
احسب القوة المحركة الكهربائية للخلية في اللحظتين اللتين يصبح فيها تركيز شوارد التوتياء 0,19mol/L و 0,1999mol/L على التوالي.
ب ـ احسب نسبة التراكيز [+Zn2+]/[Cu2] حتى تنعدم القوة المحركة الكهربائية في الخلية.
ج ـ ناقش الإجراءات التالية لكي يتم التفاعل:
+Cu2+ + Zn↔ Cu + Zn2
في الخلية من اليمين إلى اليسار:
1 ـ زيادة تركيز شوارد التوتياء.
2ـ تطبيق تيار متناوب.
3ـ تطبيق تيار مستمر.
أ ـ إن كمون الخلية يُساوي الكمون العياري لها ويساوي 1,10V.
من المعلوم أن شوارد النحاس تتناقص خلال التفاعل بنفس المقدار الذي تزداد فيه شوارد التوتياء،
فعندما يزداد [+Zn2] من 0,1mol/L إلى 0,19mol/L
فإن الزيادة في تركيز شوارد التوتياء يساوي إلى (0,19-0,1=0,09mol/L)
وهذه الزيادة يرافقها تناقص في تركيز شوارد النحاس بذات المقدار
وعليه فإن شوارد النحاس تتناقص من 0,1mol/L إلى (0,1-0,09=0,01mol/L) .
وبالتعويض في معادلة نرنست:
و عندما تزداد [+Zn2] من 0,1mol/L إلى 0,1999mol/L
فإن الزيادة في تركيز شوارد التوتياء يساوي 0,0999mol/L
وهذه الزيادة يرافقها تناقص في تركيز شوارد النحاس بذات المقدار
وعليه فإن شوارد النحاس تتناقص من 0,1mol/L إلى (0,1- 0,0999=0,0001mol/L) .
وبالتعويض في معادلة نرنست:
يُمكن إيجاد قيمة النسبة ![]() التي تجعل كمون الخلية معدوماً:
التي تجعل كمون الخلية معدوماً:
![]() =1037 وهي قيمة من الصعب تحقيقها عملياً.
=1037 وهي قيمة من الصعب تحقيقها عملياً.
ج ـ يُستنتج مما سبق أن التفاعل +Cu2+ + Zn ↔ Cu + Zn2 منزاح كلياً نحو اليمين.
1ـ لا يمكن[1] عن طريق زيادة تركيز +Zn2 أن ينحرف التفاعل نحو اليسار
لأنه من الصعب عملياً تحقيق المتراجحة: ![]() >1037
>1037
2ـ ولا يمكن إزاحة التفاعل نحو اليسار بتطبيق تيار متناوب
لأن هذا التيار يزيح التفاعل تارة نحو اليمين وتارة أخرى نحو اليسار.
3ـ لكن بتطبيق تيار مستمر ينزاح التفاعل نحو اليسار
إذا وُصل مسرى النحاس بالقطب الموجب للمنبع الكهربائي المستمر
ووصل مسرى التوتياء بالقطب السالب له،
وفي هذه الحالة تُجبَر الإلكترونات أن تمر في الدارة الخارجية
من مسرى النحاس باتجاه مسرى التوتياء
وهذا يتم عندما تتم عملية الأكسدة على مسرى النحاس الذي يفقد الإلكترونات
( أي يُصبح مصعداً) -Cu↔Cu2++2e
بينما تتم عملية الإرجاع على مسرى التوتياء الذي يتلقى الإلكترونات
( أي يُصبح مهبطاً) +Zn+e-↔Zn2
ويكون التفاعل المحصل عكس ما يجري في الخلية الغلفانية :
Cu + Zn2+ ↔ Cu2+ + Zn
ويُقال عن هذه العملية بالتحليل الكهربائي .
تمرين ـ لتكن الخلية التالية التي تعمل عند الدرجة 25oC :
Ni|Ni2+(0,01mol/L)||Cl-(0,2mol/L)|Cl2(g,1atm)|Ptأوجد كمون هذه الخلية وفق التراكيز المعطاة، ثم أوجد تغير الطاقة الحرة ΔG لتفاعل الخلية.
يُكتب نصفي التفاعلين الموافقين لعمل هذه الخلية
وبالتالي يُمكن استنتاج التفاعل الحاصل وقيمة كمون الخلية العياري Eo .
Ni↔Ni2++2e- Eo=+0,25V
Cl2+2e-↔2Cl- Eo=+1,36V
Ni+Cl2↔Ni2++2Cl- Eo(cell) =+0,25+1,36=+1,61V
بتطبيق علاقة نرنست يُمكن إيجاد كمون الخلية وفق التراكيز المعطاة:
تمرين ـ لتكن الخلية التالية:
Sn|Sn2+ (1mol/L) ||Pb2+ (0,001mol/L) |Pb
أ ـ أوجد كمونها وفق التراكيز المعطاة واستنتج أن الخلية لا تعمل كخلية غلفانية.
ب ـ أعد تشكيل الخلية لتعمل كخلية غلفانية ، ثم أوجد قيمة كمونها وتغير الطاقة الحرة لتفاعل الخلية.
يُلاحظ من قيم كمونات المساري أن القصدير يتأكسد والرصاص يُرجَع وفق التفاعلين النصفيين التاليين:
Sn↔Sn2++2e- Eo=+0,136V
Pb2++2e-↔Pb Eo=-0,126V
Sn+Pb2+↔Sn2++Pb Eocell =+0,136-0,126=+0,001V>0
يُستنتج أن الخلية من أجل التراكيز المعيارية تعمل.
إن كمون الخلية E وفق التراكيز المعطاة:
يُستنتج أن الخلية (كمون الخلية سالب) وفق التراكيز المعطاة لا تعمل بالاتجاه المفروض لتفاعل الخلية السابق.
يُمكن الخلية أن تعمل بعكس التفاعل السابق ، وشكل الخلية الموافق هو:
Pb| Pb2+ (0.001mol/L) || Sn2+ (1mol/L) |Sn
Pb+Sn2+↔Pb2++Sn E=+0,079V
يُمكن حساب ΔG في الإتجاه الذي تعمل فيه الخلية:
ΔG=-n.F.E = -2(96500) (0,079) = -153070J <0
والتفاعل تلقائي.
تمرين ـ احسب كمون مسرى التوتياء في محلول حجمه 200cm3
يحوي 50g من كلور التوتياء، باعتبار أن تشرد الملح تاماً
وأن الكمون العياري للتوتياء يُساوي 76V- ،
والوزن الجزيئي للملح 136g/mol .
إن تفاعل الإرجاع هو: Zn2+ +2e- ↔ Zn
تمرين ـ أوجد القوة المحركة الكهربائية لخلية دانييل يبلغ تراكيز محاليل كبريتات النحاس
و كبريتات التوتياء فيها 2mol/L و 0,01mol/L على التوالي وبفرض أن التشرد تاماً.
تُطبق علاقة نرنست على التفاعلات النصفية لخلية دانييل:
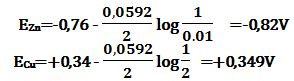
بما أن المسرى الموجب للخلية هو المسرى ذو الكمون الأعلى بالقيمة الجبرية،
لذا فالنحاس هو المسرى الموجب والتوتياء هو المسرى السالب، ويكون كمون الخلية:
Ecell = ECu-EZn=+0,349-(-0,82) =+1,169V
يُمكن تطبيق علاقة نرنست على تفاعل الخلية:
(Zn(s)+Cu2+ ↔ Zn2++Cu(s
تمرين ـ احسب كمون الأكسدة والإرجاع للزوج المتشكل في محلول
حجمه 200cm3 ويحوي 1g من كلور الحديدي و20g من كلور الحديد.
+Fe3+ +e- ↔ Fe2
تمرين ـ لتكن الخلية التالية:
Co| Co2+(0,01mol/L) || Cl- (1mol/L) |Cl2(g,1atm)|ptمستعيناً بجدول كمونات الأكسدة والإرجاع للعناصر يُطلب ما يلي:
حساب كمون الخلية القياسي، و تحديد المسرى الموجب للخلية، ثم أخيراً حساب كمون الخلية.
إن تفاعلات أنصاف الخلايا (حيث كمون الزوج 2Cl-/Cl2 أعلى منه للزوج Co2+/Co) هي:
تفاعل الإرجاع: Cl2 + 2e-↔ 2Cl- Eo2Cl-/Cl2=1,36V
تفاعل الأكسدة: Co↔ Co2+ +2e- EoCo2+/Co=0,28V
تفاعل الخلية المحصل: +Co + Cl2↔ 2Cl- + Co2
ويكون كمون الخلية القياسي:
لما كان مسرى الكوبالت هو مصدرالالكترونات التي تسري عبر السلك المعدني إلى مسرى الكلور ولما كانت جهة التيار هي عكس جهة حركة الالكترونات فالمسرى الموجب هو الكلور والمسرى السالب هو الكوبالت.
كمون الخلية :
ولما كان Cl2] = pCl2] لذلك يكون Cl2] = 1mol/L]
وبالتالي يكون كمون الخلية:
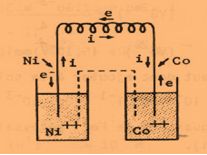
تمرين ـ لتكن الخلية المؤلفة من مسرى من النيكل مغموس في محلول مائي لأحد أملاح النيكل ومن مسرى من الكوبالت مغموس في محلول مائي لأحد أملاح الكوبالت. إن الكمونات القياسية هي:
Co2+ +2e-↔ Co Eo1=-0,277V
Ni2+ +2e- ↔ Ni Eo2=-0,250V
ـ اكتب التفاعلات النصفية على المسريين والتفاعل الكيميائي المحصل في الخلية،
ثم حدد جهة التيار الكهربائي والمسرى الموجب للخلية.
ـ بافتراض أن تركيز الأملاح متساوي، احسب كمون الخلية، وما هو المعدن المترسب؟
بما أن Eo2>Eo1 فإن عملية الإرجاع تتم على مسرى النيكل:
Ni2+ +2e- ↔ Ni
بينما تتم عملية الأكسدة على مسرى الكوبالت:
-Co↔ Co2+ +2e
ويكون التفاعل الكيميائي المحصل في الخلية:
+Ni2+ + Co ↔ Ni + Co2
ox1 red2 red1 ox2
تذهب الالكترونات من مسرى الكوبالت باتجاه مسرى النيكل،
والمسرى الموجب هو الذي يحصل عنده عملية إرجاع وبالتالي
فمسرى النيكل هو المسرى الموجب[1] ويكون بالمقابل مسرى الكوبالت هو المسرى السالب.
إن جهة حركة التيار الكهربائي هي بعكس جهة الالكترونات.
ويكون الكمون القياسي للخلية:
Eo=Eo2 – Eo1 =-0,250-(-0,277)=0,027Vأما كمون الخلية فيعطى بعلاقة نرنست:
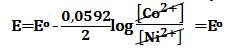
والمعدن المترسب هو النيكل.
تمرين ـ إذا علمت أن كمون الزوج H3O+/H2 يُساوي إلى الصفر،
وأن كمون الزوج 0.5O2/H2O يُساوي 1,23V
فبرهن أن عملية تفكك الماء (إلى H2 و O2) مستحيلة.
0.5O2 +2H3O+ +2e-↔3H2O Eo=1,23V
2H3O+ + 2e-↔H2 (g) +2H2O Eo=0V
بما أن كمون الزوج الأول أكبر من كمون الزوج الثاني فإن التفاعل الأول تفاعل أكسدة بينما التفاعل الثاني تفاعل إرجاع، أي:
3H2O↔0.5O2 +2H3O+ +2e- Eo=-1,23V
2H3O+ + 2e-↔H2 (g) +2H2O Eo=0V
وبجمع التفاعلين والاختزال:
H2O↔H2+0.5O2 Eo=-1,23+0=-1,23V<0
وبالتالي فالتفاعل السابق مستحيل (غير تلقائي)، وبالتالي فجزيئة الماء ثابتة.
تمرين ـ استنتج من قيم كمون الأكسدة والإرجاع اتجاه حدوث التفاعل:
(AsO43-+2H++2I- ↔ AsO33-+I2+H2O (1
في الحالتين التاليتين:
أـ عندما يكون: AsO43-]=[AsO33-]=[H+]=1]
ب ـ عندما يكون: [AsO43-]=[AsO33-] =1 ; [H+]=10-7]
مع العلم بأن كمون الزوج -I2/2I في التفاعل المذكور يُساوي 534V+
وأن درجة الحرارة تُساوي 25oC، كما أن الكمون العياري للزوج -AsO43-/AsO33 يُساوي 0,559V+
ج ـ ماذا تستنتج؟
إن التفاعل (1) هو محصلة للتفاعلين النصفيين:
(AsO43- +2H++2e-↔AsO33-+H2O (2
(I2+2e-↔2I- (3
فلتعيين اتجاه حدوث التفاعل يعين كمونا الأكسدة والإرجاع في كل حالة ويقارن بين قيمها.
أـ بما أن كل الشوارد موجودة في المحلول بتركيز 1mol/L لكل منها ،
فإن كمون الزوجين -AsO43-/AsO33 و -I2/2I هو الكمون العياري الخاص بكل منهما.
وبما أن كمون الزوج الأول (0,559V+) أكبر من كمون الزوج الثاني (0,534V+)
فالتفاعل (2) تفاعل أكسدة واتجاهه كما هو مكتوب من اليسار إلى اليمين ،
بينما يكون التفاعل (3) هو تفاعل إرجاع وجهته في الإتجاه المعاكس لما هو مكتوب أي من اليمين إلى اليسار:
AsO43- +2H++2e-↔AsO33-+H2O Eo =+0,559V
2I-↔I2+2e- Eo =-0,534V
والتفاعل المحصل هو جمع هذين التفاعلين:
AsO43-+2H++2I- ↔ AsO33-+I2+H2O
Ecell=+0,559+ (-0,534) =+0,025V
ب ـ يحسب الكمون الموافق للمعادلة (2) من علاقة نرنست:
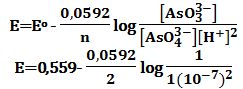
E=+0.146V
يلاحظ أن هذا الكمون (0,146V+) أصغر من (0,534V+) الذي هو كمون الزوج -I2/2I ، أي (0,534+>0,146+) ،
لذلك فإن التفاعل (3) هو تفاعل الأكسدة والتفاعل (2) هو تفاعل الإرجاع:
AsO33-+H2O↔ AsO43- +2H++2e- Eo=-0,146V
I2+2e-↔2I- Eo=+0,534V
والتفاعل المحصل هو جمع هذين التفاعلين:
AsO33-+H2O+I2↔ AsO43- +2H++2I- Eo=-0,146V+0,534V=+0,388V
ج ـ يستنتج أن قدرة شاردة الزرنيخات على الأكسدة تتعلق بحموضة الوسط ،
فتزداد في الوسط الحمضي وتؤكسد شوارد اليود في هذا الوسط.
أما في الوسط المعتدل حيث H+]=10-7] فإن اليود الحر يكون أعظم قدرة على الأكسدة
فيؤكسد شوارد الزرنيخات إلى الزرنيخيت.
وبتعبير آخر إن شاردة الزرنيخات أعظم ثباتاً من شاردة الزرنيخيت في وسط معتدل ،
ويحصل العكس في الوسط الحمضي.
تمرين ـ أولاً: أوجد عبارة ثابت التوازن لتفاعل الأكسدة والإرجاع التالي:
2Fe3+ + 2I- ↔ 2Fe2+ + I2
بدلالة كموني الأكسدة والإرجاع القياسيين للزوجين +Fe3+/Fe2 و -I2/2I
ثانياً: احسب ثابت توازن التفاعل المتعلق بالخلية للزوجين السابقين.
المعطيات: EoFe3+/Fe2+ =+0,77V , EoI2/2I- =+0,54V
في حالة التوازن يكون:
+EI2/2I- = EFe3+/Fe2
وبتطبيق علاقة نرنست:
حيث ثابت التوازن:
يُلاحظ أن ثابت التوازن يزداد كلما ازداد الفرق بين الكمونين القياسيين لزوجي الأكسدة والإرجاع.
ويتعين تماماً سير التفاعل من قيمة Kox/red ،
ويعتبر التفاعل لاعكوساً عملياً عندما Kox/red ≥103
التفاعلين النصفيين للخلية هما:
2Fe3++2e-↔2Fe2+ Eo =+0,77V تفاعل إرجاع
2I- ↔ I2+2e- Eo=-0,54V تفاعل أكسدة
التفاعل المحصل للخلية:
2Fe3++2I-↔2Fe2++I2 ; Eocell=+0,77-0,54=+0,23V
تمرين ـ بإرجاع شاردة البرومات -BrO3 إلى شاردة البروم -Br في وسط حمضي وبواسطة التوتياء،
وبفرض أن كمون الإرجاع العياري لشاردة البرومات يُساوي 0,61V+
وأن الكمون العياري المسروي للتوتياء هو 0,763V-
والمطلوب كتابة تفاعلات الأكسدة والإرجاع الحاصلة
و التفاعل الكلي حتى تعمل الخلية،
ثم حساب القوة المحركة الكهربائية للخلية (الكمون العياريEo )،
وكذلك حساب قيمة تغير الطاقة الحرة ΔGo وثابت التوازن K للخلية أثناء توازنها.
(BrO3- +6H++6e-↔3H2O+Br- Eo1=+0,61V (1 تفاعل إرجاع
(Zn↔Zn2++2e- Eo2=+0,763V (2 تفاعل أكسدة
لتوحيد عدد الالكترونات تُضرب المعادلة (2) بالعامل 3 وتُجمع المعادلة الجديدة مع المعادلة (1):
BrO3- +6H++Zn2+↔3H2O+Br-+Zn Eo=+0,61V+0,763=1,373V
ΔGo=-n.F.Eo=-6.(96500).(1,373)=-794967J
تمرين ـ إن قيمة الكمون العياري للتفاعل الحاصل عند غمس قطعة من الحديد في محلول شوارد التوتياء تركيزه 1mol/L يساوي Eo=-0,32V .
ما هو تركيز شاردة الحديدي +Fe2 في حالة التوازن ؟
Fe+Zn2+↔Fe2++Zn Eo =-0,36V
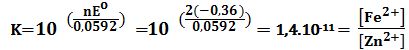
ومنه :
Fe2+] = K. [Zn2+] = (1,4.10-11).(1) = 1,4.10-11 mol/L]
تمرين ـ هل تعمل الخلية التالية كخلية غلفانية؟
Pt|Cl2(g,1atm) |Cl-(1mol/L) ||Cu2+(1mol/L) |Cu(s)
أكسدة على المسرى اليساري (مسرى الكلور):
2Cl- (1mol/L) ↔ Cl2(g,1atm) +2e- Eoox = -(+1,36V)إرجاع على المسرى اليميني (مسرى النحاس):
Cu2+(1mol/L) +2e- ↔ Cu(s) Eored = +0,337Vويكون تفاعل الخلية:
Cu2+(1mol/L) +2Cl- (1mol/L) ↔Cu(s)+Cl2(g,1atm) Eo =-1,36+0,337<0فالتفاعل غير تلقائي والخلية لا تعمل كخلية غلفانية.
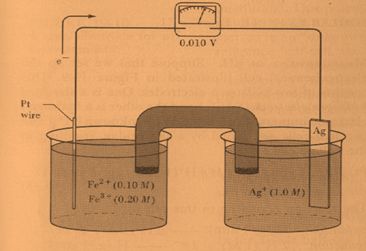
تمرين ـ 1ـ احسب كمون الخلية التالية:
2ـ ما هو التركيز الأدنى لشوارد الفضة +Ag لكي تعمل الخلية التالية كخلية غلفانية:
(Pt|Fe2+(0,1mol/L),Fe3+(0,20mol/L) ||Ag+(?mol/L) |Ag(s
1ـ يُحسب كمون الخلية القياسي Eo :
Fe2+(aq)↔Fe3+(aq)+e- Eoox= -(+0,771)V
Ag+(aq)+e-↔Ag(s) Eored=+0,799V
(Fe2+(aq)+ Ag+(aq)↔Fe3+(aq)+ Ag(s
Eocell=-0,771+0,799=+0,028V>0
فالتفاعل تلقائي وتعمل الخلية بالتراكيز القياسية كخلية غلفانية. و لحساب كمونها
تُطبق علاقة نرنست:
فالتفاعل تلقائي وتعمل الخلية بالتراكيز المعطاة كخلية غلفانية.
2ـ من الطلب الأول إن الكمون القياسي للخلية Eocell = +0,028V
ولحساب التركيز الأدنى لشوارد الفضة كي تعمل الخلية
يُفترَض مبدئياً أن الخلية في حالة توازن أي أن كمون الخلية معدوم ومنه:
أي: Log [Ag+] = -0,17
أو: Ag+]=0,68mol/L]
وهو التركيز الأدنى لشوارد الفضة كي تعمل الخلية.
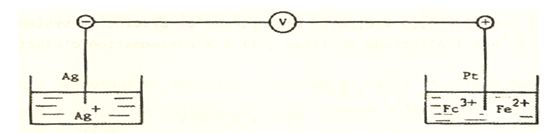
تمرين ـ لدراسة التوازن:
+Ag + Fe3+ ↔ Ag+ + Fe2
يُحضر المزيج التالي: 50cm3 من محلول AgNO3 تركيزه 0,6mol/L
مع 25cm3 من محلول لشوارد الحديدي +Fe2 تركيزه 0,1mol/L
و 25cm3 من محلول لشوارد الحديد +Fe3 تركيزه 1mol/L
والمطلوب:
اـ في أي اتجاه يسير التفاعل السابق ليصل إلى مرحلة التوازن؟ ثم احسب ثابت التوازن.
ب ـ بالإعتماد على المحاليل السابقة ، كيف يُمكن عمل خلية غلفانية؟
ج ـ ما هي النسبة الدنيا من +Fe3+/Fe2 لكي يغير التفاعل اتجاهه؟
المعطيات : Eo(Ag+/Ag)=+0,800V , Eo(Fe3+/Fe2+)=+0,770V
Ag+ + e- ↔ Ag Eo1=+0,800V
Fe3++e- ↔ Fe2+ Eo2=+0,770V
تُحسب الكمونات الابتدائية قبل حدوث التفاعل:
أثناء التفاعل تزداد E1 وتتناقص E2 حتى الوصول إلى مرحلة التوازن حيث E1=E2 ،
ويسير التفاعل في الإتجاه المباشر حيث يزداد [+Ag] الذي يجعل E1 تزداد.
إن تناقص E2 يتطلب زيادة [+Fe2] وتناقص [+Fe3]،
أي يسير التفاعل في الاتجاه المباشر.
في حالة التوازن :
0,0592.log Keq= Eo1-Eo2=0,770-0,800=-0,03 → Keq≈0,3
ب ـ يجب فصل جملتي (زوجي) الأكسدة والإرجاع: Ag+/Ag و +Fe3+/Fe2 .
E=E2-E1=0,830-0,769=0,061V
ج ـ يُغير التفاعل اتجاهه عندما تُصبح E2=E1 ،
وبما أن E1=0,769V لذلك فكمون الزوج +Fe3+/Fe2 يُصبح 0,769V
تمرين ـ أـ احسب القوة المحركة الكهربائية للخلية التركيزية التالية:
Ag|Ag+I(10-5mol/L) || Ag+II(0,1mol/L) |Ag
ب ـ كيف تتغير القوة المحركة الكهربائية إذا أُضيف للخلية اليسرى
محلول كلور الصوديوم بتركيز أعلى من
10-5mol/L.
ج ـ عبر عن القوة المحركة الكهربائية بدلالة تركيز شوارد الكلور، علماً أن Ksp(AgCl)=10-10
أ ـ أكسدة على المسرى الأيسر:
إرجاع على المسرى الأيمن:
ب ـ بإضافة كلور الصوديوم فإن -Cl سوف تزداد وعندما يكون Cl-]>10-5mol/L]
فإنه يترسب AgCl (لأن الجداء الشاردي يفوق جداء الإنحلال)
وبالتالي ينخفض Ag+]I] وينتج عن ذلك ازدياد قيمة القوة المحركة الكهربائية للخلية:
ج ـ
بما أن:
[-Ag+]I=Ksp(AgCl).[Cl-]=10-10.[Cl]
و Ag+]II=0,1mol/L]
يُمكن إعادة كتابة كمون الخلية بالشكل التالي:
[-E=+0,5328 + 0,0592log[Cl
يُلاحظ أن كمون الخلية لا يتعلق إلاَّ بتركيز شوارد الكلور.
تمرين ـ عندما تغمر صفيحة من النحاس في محلول أحد أملاحه يجري التفاعل:
+Cu+Cu2+↔2Cu
إذا كانت قيمة النسبة [+Cu+]2/[Cu2] في حالة التوازن في الدرجة 25oC تساوي
5.10-5 والمطلوب إيجاد الكمون القياسي (Eo(Cu+/Cu
إذا علمت أن Eo(Cu2+/Cu)=+0,33V .
Cu2+ + 2e-↔2Cu Eo1=+0,33V إرجاع
2Cu↔2Cu+ +2e- Eo2 أكسدة
Cu+Cu2+↔2Cu+ Eo=Eo1+Eo2
في حالة التوازن :
Eo2=-0,475V
ويكون بالتالي الكمون القياسي للزوج Cu+/Cu ( كمون الإرجاع) مساوياً Eo2-
أي: Eo(Cu+/Cu)=+0,475V
تمرين ـ إذا كان الكمون القياسي للزوج (للمسرى) Ag+/Ag يساوي 0,799V+
وكان ثابت التوازن للتفاعل: +Fe3++Ag↔Fe2++Ag في الدرجة 25oC يساوي إلى 0,53 ،
فاحسب الكمون القياسي للزوج +Fe3+/Fe2.
Ag++e-↔ Ag Eo1=0,799V
Fe3++e-↔Fe2+ Eo2
تمرين ـ يُمكن حساب ثابت جداء الإنحلال للأملاح الضعيفة الإنحلال من خلال بعض الخلايا .
تُشكل خلية غلفانية من مسريين:
الأول سلك من الفضة مغموس في محلول شوارد الفضة ،
والثاني سلك من الفضة مغموس في محلول شوارد البروم ومشبع ببروم الفضة:
الأول والثاني هما 0,7991V+ و 0,0713V+ على الترتيب.
التفاعلات النصفية على المساري:
Ag↔Ag++e- Eo1=-Eo(Ag+/Ag)= -0,7991V
AgBr(s) +e- ↔ Ag +Br - Eo2=Eo(AgBr/Ag)=+0,0713V
ويكون التفاعل المحصل للخلية:
AgBr(s) ↔ Ag+ +Br - Eo= -0,7991+0,0713V =-0,7278V
وعنما تصل الجملة إلى حالة التوازن فإن كمون الخلية يصبح معدوماً
ويُصبح الجداء [-Ag+][Br] مساوياً لثابت جداء الإنحلال لبروم الفضة:
Ksp(AgBr(s))=([Ag+][Br -])equilibrium
ومنه:
يُمكن الوصول إلى النتيجة ذاتها بتساوي كمونا الزوجين Ag+/Ag و AgBr/Ag
اللذين ينتميان إلى الجملة ذاتها (Ag(I)/Ag(0:
(E(Ag+/Ag)=E(AgBr/Ag
تمرين ـ يوضع في لتر من الماء مقدار 0,01mol من كل من الأملاح التالية:
ZnS و CdS و CuS و Ag2S و HgS .
برهن أنه يمكن باستخدام مفهوم الأكسدة والإرجاع استنتاج أن انحلال هذه الأملاح يتم على التتابع.
المعطيات: Eo(S(s)/S2-)=-0,50V ; PKsp(ZnS)=21
PKsp(Ag2S)=49 ; PKsp(CdS)=26 ; PKsp(CuS)=36 ; PKsp(HgS)=53
لكن E1=E2 لأن الزوجين ينتميان إلى جملة واحدة (S(0)/S(-II ، أي أن :
(E2o = - 0,50 -0,0296 log Ksp(MS
أي أن الكمون القياسي للزوج S(s)/MS يزداد كلما يزداد المقدار (logKsp(MS- .
ومنه:
E2o(Ag(I))=0,97V ; E2o(Cd(II))=0,28V ; E2o(Cu(II))=0,58V
E2o(Hg(II))=1,09V ; E2o(Zn(II))=0,13V
أي يمكن حل (ذوبان) الأملاح ZnS و CdS و CuS و Ag2S وأخيراً HgS على التوالي.
تمرين ـ يُمزج 0,1mol/L من -IO3 مع 0,1mol/L من -I ويُضاف إليها 0,001mol/L من حمض قوي.
احسب PH المحلول كذلك كمون الأكسدة وارجاع.
المعطيات:
( Eo(I2/I-)=0,62V ; Eo(IO3-/I2)=1,19 (at PH=0
إضافة تعليق
التعديل الأخير تم: 12/07/2021